题目内容
【题目】小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量。(已知白磷的着火点是40℃,红磷的着火点是240℃)
实验装置 | 实验过程 | 实验现象 |
| ①取一烧杯,加入适量的生石灰,再分别取少量白磷、红磷放在烧杯上的铜片上. ②… | 一会儿白磷发生燃烧,红磷不燃烧 |
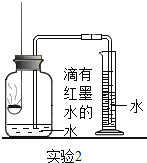
| ③先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,在燃烧匙中放足量白磷,量筒中盛入足量水. ④按图连好仪器,用激光手电照射白磷,白磷燃烧. | 集气瓶和量筒中的水均为红色,量筒内的液体体积减少约60mL |
(1)实验过程②是_____,烧杯中发生反应的化学方程式为_____;
(2)白磷燃烧反应的化学方程式为_____;
(3)根据实验2的结果,计算空气中氧气的体积分数约为_____(写出计算式和结果);
(4)在整个实验2的过程中,集气瓶内的压强变化是_____。
(5)集气瓶中预先装入50mL水,水起的作用是_____。
【答案】向烧杯中加入适量的冷水 CaO+H2O=Ca(OH)2 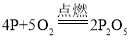
![]() 先变大后变小到与大气压相等 吸收白烟,同时防止集气瓶内的空气因瓶内温度升高、压强增大而逸散到瓶外
先变大后变小到与大气压相等 吸收白烟,同时防止集气瓶内的空气因瓶内温度升高、压强增大而逸散到瓶外
【解析】
(1)白磷发生燃烧,温度需达到着火点,生石灰与水反应生成氢氧化钙,放出大量的热,故实验过程②是向烧杯中加入适量的冷水,反应的化学方程式为:CaO+H2O═Ca(OH)2.
(2)白磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5.
2P2O5.
(3)根据题意,先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,即集气瓶内空气的体积为350mL-50mL;完全反应后量筒内的液体体积减少约60mL,即被消耗掉的氧气的体积为60mL,则空气中氧气的体积分数约为![]() =
=![]() .
.
(4)白磷燃烧放出大量的热,使装置内气体受热膨胀,压强增大;后消耗氧气使装置内压强减小,冷却至室温后与大气压相等,故在整个实验2的过程中,集气瓶内的压强变化是先变大后变小到与大气压相等.
(5)集气瓶中预先装入50mL水,水能降低温度,故水起的作用是吸收白烟,同时防止集气瓶内的空气因瓶内温度升高、压强增大而逸散到瓶外.
故答案为:(1)向烧杯中加入适量的冷水;CaO+H2O═Ca(OH)2;(2)4P+5O2![]() 2P2O5;(3)
2P2O5;(3)![]() =
=![]() ;(4)先变大后变小到与大气压相等;(5)吸收白烟,同时防止集气瓶内的空气因瓶内温度升高、压强增大而逸散到瓶外.
;(4)先变大后变小到与大气压相等;(5)吸收白烟,同时防止集气瓶内的空气因瓶内温度升高、压强增大而逸散到瓶外.

【题目】甲烷是一种清洁燃料。某密闭容器中有甲烷(![]() )、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
)、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
物质 |
|
|
|
|
反应前质量 | 16 | 70 | 1 | 0 |
反应后质量 | 0 | X | 45 | 36 |
A. 日常燃烧甲烷不会产生温室气体
B. 表中“X”值为6
C. 该反应为分解反应
D. 16g甲烷在50g氧气中燃烧会生成![]()