题目内容
通过一个学期的化学学习,同学们初步掌握了实验室制取气体的知识和技能,根据图所示装置,请完成下列实验内容。
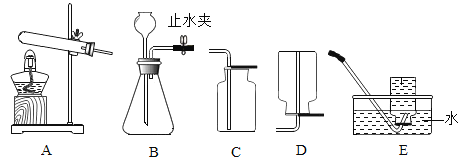
(制取气体并检验)
实验名称 | 选用药品 | 化学方程式 | 制取装置 | 检验气体操作 |
制取CO2 | _____ | _____ | _____ | 集气瓶中加入澄清石灰水,观察现象 |
制取O2 | _____ | _____ | B C | _____ |
氯酸钾、二氧化锰 | _____ | _____ |
(探究活动)查阅资料:过氧化钠(淡黄色固体)和二氧化碳可以发生反应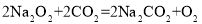 。该反应能否用于实验室制取O2,并说明理由_____。
。该反应能否用于实验室制取O2,并说明理由_____。
下列实验方法能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 除去FeCl2溶液中的CuCl2 | 加入足量锌粉 |
B | 检验一瓶气体是否为CO2 | 将燃着的木条伸入瓶中 |
C | 检验蜡烛燃烧的产物中是否有水 | 在火焰上方罩一只冷而干燥的烧杯 |
D | 分离铜粉和铁粉 | 加水,过滤 |
A.A B.B C.C D.D
小明通过阅读《科学的历程》知道质量守恒定律的发现经历了漫长、曲折的过程。
历程与思考
历程一:早在1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,打开容器盖冷却后称量,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂你认为质量增大的原因是_____。
历程二:1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,发现总质量和煅烧前没有变化。
历程三:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,从而总结出了质量守恒定律。拉瓦锡还通过这个实验研究了_____,成就了化学史上的另一经典实验。
验证与拓展
为了验证科学家们发现的质量守恒定律,小明设计了如图所示的三个实验,
(实验步骤)

如图所示,甲、乙实验,用砝码使天平平衡后,随即使其发生反应,丙实验对石棉网和打磨干净的镁条进行反应前后的称量。三组实验小明都进行了规范的操作以及准确的称量和认真观察。请完成下表内容。
实验 | 实验现象 | 反应化学方程式 |
甲 | _____ |
|
乙 | _____ | _____ |
丙 | _____ | _____ |
(实验分析)通过对上述实验的对比分析,小明认为实验甲遵守质量守恒定律,而实验乙和丙不遵守质量守恒。小组同学认为小明这种说法不正确,请分析导致实验乙和丙反应前后称量质量不相等的原因_____。
(实验结论)化学反应都遵守质量守恒定律。
请从微观的角度分析化学反应遵循质量守恒的原因是_____。
(实验拓展)小明查阅资料发现,实验甲得到的铜在工业上能与氯化铜溶液和盐酸在50℃时反应制作电路,生成物经处理又能转化为氯化铜。反应如下:
①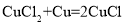 ;②
;② ;③
;③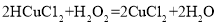
(1)反应②中X的化学式为_____。
(2)反应①中氯化铜的质量_____(填“=”或“<”或“>”)反应③中氯化铜的质量。
(3)反应①结束后,进行蒸发操作得到固体的质量为10.66g,其中铜元素的质量为6.4g该固体的成分为_____。


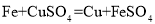
 ,避免了传统电池所带来的污染问题。则下列说法正确的是
,避免了传统电池所带来的污染问题。则下列说法正确的是