题目内容
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 40 | m |
| 第2次 | 40 | 14.8 |
| 第3次 | 40 | 12.2 |
| 第4次 | 40 | 11.2 |
| 第5次 | 40 | 11.2 |
(1)从以上数据可知,最后剩余的11.2g固体的成分是______;表格中,m=______.
(2)黄铜样品中锌的质量分数为______.
(3)计算所用稀硫酸中硫酸的质量分数是多少?
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少?
【答案】分析:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,第4次再加入40g稀硫酸时,第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应,反应掉的锌的质量为:14.8g-12.2g=2.6g,据此分析m的值,由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)根据金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数;
(3)根据上述分析可知,40g稀硫酸完全反应时反应掉了2.6g的锌.根据反应的化学方程式,可求出40g稀硫酸中参加反应硫酸的质量,根据溶质质量分数的计算公式,可以求出所用稀硫酸中硫酸的质量分数;
(4)根据在配置溶液时,溶质的质量不变原理进行计算.
解答:解:(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第4次再加入40g稀硫酸时.第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应.反应掉的锌的质量为:14.8g-12.2g=2.6g,据此分析,m=14.8g+2.6g=17.4g.由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)黄铜样品中锌的质量分数为: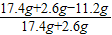 ×100%=44%;
×100%=44%;
(3)设40g稀硫酸中硫酸的质量为X
H2SO4 +Zn═ZnSO4+H2↑(1分)
98 65
x 2.6g
 解得:X=3.92g
解得:X=3.92g
稀硫酸中硫酸的质量分数为: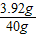 ×100%=9.8%
×100%=9.8%
(4)设需要质量分数为98%浓硫酸的质量为Y 则
100g×9.8%=Y×98% 解得;Y=10g
故答为:(1)Cu,17.4; (2)44%;(3)9.8%;(4)10g.
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.
(2)根据金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数;
(3)根据上述分析可知,40g稀硫酸完全反应时反应掉了2.6g的锌.根据反应的化学方程式,可求出40g稀硫酸中参加反应硫酸的质量,根据溶质质量分数的计算公式,可以求出所用稀硫酸中硫酸的质量分数;
(4)根据在配置溶液时,溶质的质量不变原理进行计算.
解答:解:(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第4次再加入40g稀硫酸时.第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应.反应掉的锌的质量为:14.8g-12.2g=2.6g,据此分析,m=14.8g+2.6g=17.4g.由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)黄铜样品中锌的质量分数为:
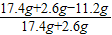 ×100%=44%;
×100%=44%;(3)设40g稀硫酸中硫酸的质量为X
H2SO4 +Zn═ZnSO4+H2↑(1分)
98 65
x 2.6g
 解得:X=3.92g
解得:X=3.92g稀硫酸中硫酸的质量分数为:
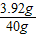 ×100%=9.8%
×100%=9.8%(4)设需要质量分数为98%浓硫酸的质量为Y 则
100g×9.8%=Y×98% 解得;Y=10g
故答为:(1)Cu,17.4; (2)44%;(3)9.8%;(4)10g.
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:
(1)m= ;
(2)该黄铜样品中锌的质量分数为 ;
(3)所用稀硫酸中溶质的质量分数为 .
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的质量(g) | 50 | 50 | 50 |
| 生成氢气的质量(g) | 0.4 | m | 0.2 |
(1)m=
(2)该黄铜样品中锌的质量分数为
(3)所用稀硫酸中溶质的质量分数为
 (2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.