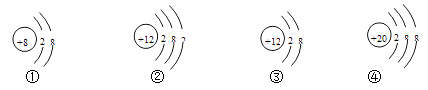题目内容
【题目】下图中①、②为氧元素、铝元素在元素周期表中的信息示意图,A,B,C,D是四种粒子的结构示意图.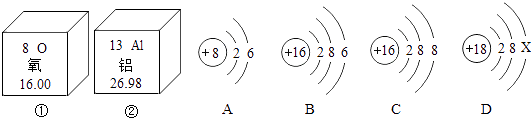
(1)氧元素属于元素(填“金属”或“非金属”);铝元素的质子数是 .
(2)C粒子属于(填“原子”、“阴离子”或“阳离子”);若D为原子,则ⅹ= .
(3)A,B,C,D中属于同种元素的是(填序号).
(4)A粒子的化学性质与B,C,D中哪一种粒子的化学性质相似(填序号).
【答案】
(1)非金属,13
(2)阴离子,8
(3)BC
(4)B
【解析】(1)氧元素的原子结构核外最外层电子为6,易得到电子形成稳定结构,属于非金属元素;根据铝元素在元素周期表中的信息示意图可知,铝元素的质子数是13。
(2)C粒子性质的判定,从核内质子数是17,而核外电子数为2+8+8=18,可以看出外面电子多,所以应该为阴离子.而对于D原子,由于是核外电子数等于核内质子数,所以X=18﹣(2+8)=8。
(3)属于同种元素的微粒,根据元素是具有相同质子数的原子的总称可知道,只要是单原子或者离子,核内质子数相同就属于同一元素的微粒,图中B、C质子数都是16,所以它们二者属于同一元素的微粒.故答案为BC。
(4)根据元素的化学性质取决于最外层电子数,A粒子的最外层电子数为6,B中硫原子的最外层电子数也为6,所以二者的化学性质相似,故选择:B.
(1)最外层电子数大于等于4的原子是非金属元素;元素序号等于原子核内质子数;(2)质子数<电子数,为阴离子,质子数>电子数,为阳离子,质子数=电子数,为原子;(3)单原子或者离子,核内质子数相同就属于同一元素的微粒;(4)原子的最外层电子数相同,化学性质相似。

【题目】为测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
1 | 2 | 3 | |
合金质量/g | 25 | 25 | 50 |
稀H2SO4的质量/g | 120 | 160 | 100 |
生成H2的质量/g | 0.4 | 0.4 | 0.4 |
(1)从上表数据分析,当所取黄铜合金与所用稀硫酸的质量比为时,表明合金中的锌与稀硫酸恰好完全反应。
(2)反应前稀硫酸中溶质的质量分数是多少?
【题目】现有含碳酸钠的食盐样品,为测定样品中氯化钠的含量,课外活动小组的同学称取10g食盐样品于烧杯中,并将40g稀盐酸平均分成四次加入烧杯中,实验数据见下表:
实验序号 | 加入稀盐 | 反应后烧杯中 |
第一次 | 10 | 19.56 |
第二次 | 10 | 29.12 |
第三次 | 10 | 38.9 |
第四次 | 10 | 48.9 |
(1)求产生CO2气体的总质量。
(2)求样品中氯化钠的纯度。
(3)求使用的稀盐酸的溶质质量分数。
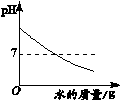
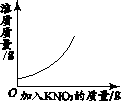
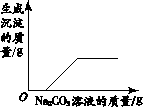
【题目】下列4个图像能正确反映对应变化关系的是( )
A | B | C | D |
|
|
|
|
向一定量NaOH溶液中加水 | 向一定量不饱和KNO3溶液中逐渐加入KNO3固体 | 向一定量澄清石灰水中加入Na2CO3溶液 | 向等质量的Mg、MgO中加入稀盐酸 |
A.A
B.B
C.C
D.D