��Ŀ����
����Ŀ���Ȼ�������Ҫ�Ļ���ԭ�ϣ��ȼҵ������һ��������ͼ��
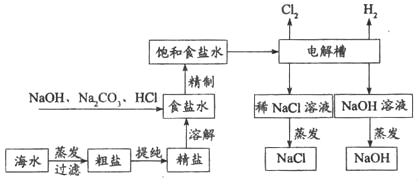
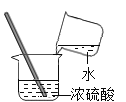
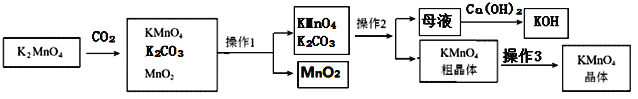
��1��������ˮҶ����Ҷ�������Ĺ��̰����ܽ⡢���ˡ�������ʵ�������ʵ����������3�ֲ�������Ҫʹ�õ�������_____�������ƣ��������������������е�������_____��
��2����ʳ��ˮ���г�����NaCl��MgCl2��CaCl2�����ʣ��������������м���NaOH��Ŀ����_____��
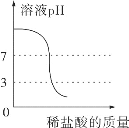
��3��20��ʱ��������ʳ��ˮ����������������Ϊ26.47%������¶��£��Ȼ��Ƶ��ܽ��Ϊ_____����������ȷ��0.1����
��4��д�����������з�����Ӧ�Ļ�ѧ����ʽ��_____��
��5�������п���ѭ��ʹ�õ�������_____���ѧʽ����
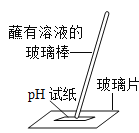
��6���ȼҵ�����ļ���Ʒ�г�����Na2CO3��NaCl�����ʣ�����Ʒ�к���Na2CO3��ԭ����_____���������Ʒ���Ƿ���Na2CO3�������Լ��п�ѡ��ʹ�õ���_____������ĸ����
A ��̪��Һ B ʯ����Һ C �������Һ D ����ʯ��ˮ
��7���������ӽ���Ĥ���������ļ���Ʒ������Ҫ�����±���ʾ��
�ȼ� | �������ƺ��� | ̼���ƺ��� |
�ŵ�Ʒ | ��99.0% | ��0.5% |
һ��Ʒ | ��98.5% | ��0.8% |
�ϸ�Ʒ | ��98.0% | ��1.0% |
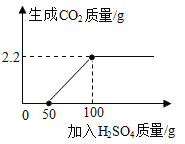
��ѧ��ȤB����Ʋ����������ʵ�����жϼ���Ʒ�ĵȼ����������������ʲμӷ�Ӧ������ȡ20.3 g����Ʒ������������ˮ�ܽ⣬�ټ����������Ȼ�����Һ����ַ�Ӧ���˵õ���������Һ��������ϴ�ӡ�����õ�̼�ᱵ����0.197 g������Һ�м���2�η�̪������μ���ϡ������ǡ����ȫ��Ӧ��������������������Ϊ5.0%��ϡ����365 g��
�ٸü���Ʒ��̼���Ƶĺ���������������Ϊ_____����������ȷ��0.01% ����
����ʽ����ü���Ʒ���������Ƶĺ���_____����������ȷ��0.01% ����
�۸ü���Ʒ�ĵȼ�Ϊ_____��
���𰸡������� ���裬��ֹ���Ȳ����������Ž� ��ȥ�Ȼ�þ 36.0g 2NaCl+2H2O![]() 2NaOH+H2��+Cl2�� NaCl��NaOH �������ƽӴ�������������̼���� D 0.52% 98.52% һ��Ʒ��
2NaOH+H2��+Cl2�� NaCl��NaOH �������ƽӴ�������������̼���� D 0.52% 98.52% һ��Ʒ��
��������
��1��������ˮҶ����Ҷ�������Ĺ��̰����ܽ⡢���ˡ�������ʵ�������ʵ����������3�ֲ�������Ҫʹ�õ������� �������������������������е������� ���裬��ֹ���Ȳ����������Ž���
��2����ʳ��ˮ���г�����NaCl��MgCl2��CaCl2�����ʣ�����������þ�����������ʣ������������������м���NaOH��Ŀ���� ��ȥ�Ȼ�þ��
��3��20��ʱ��������ʳ��ˮ����������������Ϊ26.47%������¶����Ȼ��Ƶ��ܽ��ΪS������![]() ��100%��26.47%����S��36.0g��
��100%��26.47%����S��36.0g��
��4�����������з�����Ӧ���Ȼ�����Һ��ͨ��������������������ƺ������Լ���������Ӧ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��5�������п���ѭ��ʹ�õ������� NaCl��NaOH���ѧʽ����
��6���ȼҵ�����ļ���Ʒ�г�����Na2CO3��NaCl�����ʣ�����Ʒ�к���Na2CO3��ԭ���� �������ƽӴ�������������̼���ƣ��������Ʒ���Ƿ���Na2CO3�������Ǽ��������������Ƿ���̼���ƣ������߾��Լ��ԣ����Բ��ܽ�������Խ������𣬶��ǽ�����������̼�������������Ӧ��ѡ�ó���ʯ��ˮ����ѡD��
��7����ȡ20.3 g����Ʒ������������ˮ�ܽ⣬�ټ����������Ȼ�����Һ����ַ�Ӧ���˵õ���������Һ��������ϴ�ӡ�����õ�̼�ᱵ����0.197 g������Һ�м���2�η�̪������μ���ϡ������ǡ����ȫ��Ӧ��������������������Ϊ5.0%��ϡ����365 g��
����ü���Ʒ��̼���Ƶ���������Ϊx���ü���Ʒ���������Ƶ���������Ϊy
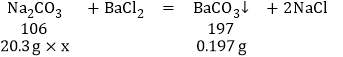
![]() ��
��![]()
x��0.52%
![]() ��
��![]()
y��98.52%
����һ��Ʒ����Ϊһ��Ʒ
�ʴ�Ϊ��
��1���������� ���裬��ֹ���Ȳ����������Ž���
��2����ȥ�Ȼ�þ��
��3��36.0g��
��4��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��5��NaCl��NaOH��
��6���������ƽӴ�������������̼���ƣ� D��
��7����0.52%
��98.52%
��һ��Ʒ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ʵ���ҳ��ù���������Һ�Ͷ�����������������ȡ������
��������⡿�����������̵������Է�Ӧ�����Ƿ���Ӱ�죿
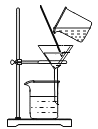
�����ʵ�顿��1��ʵ��װ����ͼ��ʾ��
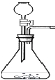

![]() ��2��ʵ���¼��ʵ���������±���
��2��ʵ���¼��ʵ���������±���
�������������ml�� | ��������Ũ�� | ��������������g�� | ����������ml�� | |
�� | 30 | 5�� | 0.1 | |
�� | 30 | 5�� | 0.2 | |
�� | 30 | 5�� | 0.3 |
��ʵ���������1����������ֽ�����ֱ���ʽΪ____________________���������̿���Ϊ�÷�Ӧ�Ĵ�����������__________________��
��2�������еġ��������ݡ��ǣ���ͬʱ����_______________________
��3����ʵ���У��ⶨ�������ݵ�װ������ͼ�����߿�������_______����������
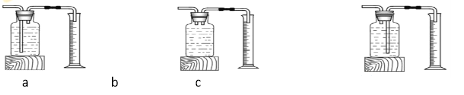
��4�����ڢ�αȵڢ��ʵ��ġ��������ݡ���______�����С����˵������������Խ�࣬��Ӧ���졣
��ʵ�鷴˼�������������ػ�Ӱ���������ķ�Ӧ�����⣬_________��дһ����Ҳ��Ӱ���������ķֽⷴӦ���ʣ���д�����ʵ�鷽����_______________________
����Ŀ����ͼ�Ǿ������ȼ����ˮ��ʾ��ͼ�����ݴ�ͼ�ش�
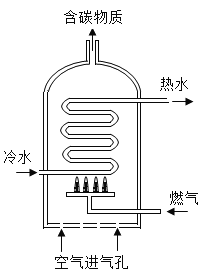
��1��ij��ˮ������Ȼ��Ϊȼ���� ����ȫȼ��3.2kg�ļ��飬����������������Ϊ______kg��
��2�����±���1kg���ֲ�ͬȼ��ȼ�ղ���CO2��SO2���������ɱ������ݿ�֪����Ȼ���DZ�ú��������Դ��ԭ����______��
ȼ�� | ȼ�ղ�������/g | |
CO2 | SO2 | |
���� | 2900 | 5.0 |
��Ȼ�� | 2500 | 0.1 |
ú | 2500 | 11.0 |