题目内容
【题目】(10分)某兴趣小组对物质的性质和成分进行相关探究。
(1)常见金属活动性顺序如下,填写相应的元素符号:
![]()
金属活动性由强逐渐减弱
某同学用硫酸铜溶液把“铁刀变成铜刀”,其反应的化学方程式为 ,该反应的基本反应类型为 。
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
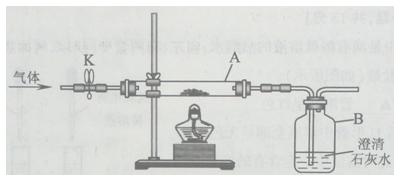
甲
[提出问题]生成的气体中是否含有一氧化碳?
[实验与讨论]
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
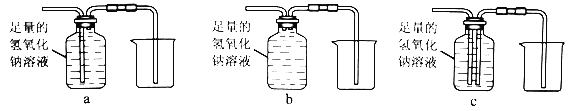
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 。
[实验求证]
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体应选用 ,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水 ,可说明气体样品中含有一氧化碳。
[实验反思]
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比 (填“大于”、“等于”或“小于”)3∶8。
【答案】(1)Mg Ag Fe+CuSO4=Cu+FeSO4 置换反应
(2)[实验与讨论] C
[实验求证] 氧化铜(或CuO) 变浑浊
[实验反思] 大于
【解析】
试题分析:(1)常见金属的金属活动性由强逐渐减弱的顺序为 K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au。所以第一个空为Mg。第二个空为Ag。
硫酸铜溶液可与铁反应生成铜,反应的化学方程式为Fe+CuSO4=Cu+FeSO4;该反应符合“一种单质和一种化合物生成另一种单质和另一种化合物的反应”的特点,属于置换反应。
(2) [提出问题]③除去气体样品中的二氧化碳,可使用氢氧化钠溶液。剩余气体的气体的密度小于瓶内溶液的密度,在上部聚集,要将气体收集在集气瓶中,应将液体从下部的导管中排出。所以装置中最为合理的是C。
[实验求证] 根据题意可知:实验探究的目的是“生成的气体中是否含有一氧化碳”。所以A中的固体应与一氧化碳在加热的情况反应。且题目中现象描述A中黑色固体变为红色,所以A中固体为氧化铜。气体样品中如有一氧化碳,则会与氧化铜反应生成铜和二氧化碳,二氧化碳气体进入B装置,可使澄清的石灰水变浑浊。
[实验反思]二氧化碳中碳、氧元素的质量比为3∶8。一氧化碳中碳、氧元素的质量比为3∶4。所以如生成的气体中含一氧化碳,则消耗碳、氧元素的质量比小于3∶8。