��Ŀ����
����ǽ�������ķ���֮һ��ij��Ƴ��������ֱ�����������п����ͭ�������ij��䣬ÿ��������Һ��������ֻ�������ܵ�п�Ρ�ͭ�κ������е�һ�����ʣ���ȡ��������ĵ��Һ���ձ��У���Ϊ1��2��3�ţ�ijС��ͬѧͨ��ʵ������ֵ��Һ�����ʳɷֽ���̽����
[�������]���ֵ��Һ�����ʵijɷ���ʲô��
[̽��ʵ��1]

[�����뽻��]��ͬѧ��Ϊ2�ŵ��Һ�е�����һ����������ͭ������Ϊ���Ľ��ۣ�1�����������ȷ������ȷ������
[̽��ʵ��2]

[��˼������]��ͬѧ��Ϊ3�ŵ��Һ�е�����һ��������п���������ͬѧ�Ľ��۸������ۣ�2���� ����
[̽��ʵ��3]��������ʵ�飬��ͬѧȡ������1�ŵ��Һ��������2�ŵ��Һ��ϣ����������У�3���������ɵ����������ɴ�С��ͬѧȷ�������ֵ��Һ�зֱ��е����ʵijɷ֣�
��������ۣ�̽��ʵ��3�з�����Ӧ�Ļ�ѧ����ʽΪ��4���� ������������ǽ����ֵ��Һ�����ʳɷֵĻ�ѧʽ��д���ձ��ı�ǩ�ϣ�5����
[�������]���ֵ��Һ�����ʵijɷ���ʲô��
[̽��ʵ��1]

[�����뽻��]��ͬѧ��Ϊ2�ŵ��Һ�е�����һ����������ͭ������Ϊ���Ľ��ۣ�1�����������ȷ������ȷ������
[̽��ʵ��2]

[��˼������]��ͬѧ��Ϊ3�ŵ��Һ�е�����һ��������п���������ͬѧ�Ľ��۸������ۣ�2���� ����
[̽��ʵ��3]��������ʵ�飬��ͬѧȡ������1�ŵ��Һ��������2�ŵ��Һ��ϣ����������У�3���������ɵ����������ɴ�С��ͬѧȷ�������ֵ��Һ�зֱ��е����ʵijɷ֣�
��������ۣ�̽��ʵ��3�з�����Ӧ�Ļ�ѧ����ʽΪ��4���� ������������ǽ����ֵ��Һ�����ʳɷֵĻ�ѧʽ��д���ձ��ı�ǩ�ϣ�5����
��1����ȷ����2������ȷ��3�ŵ��Һ�м����Ȼ�����Һ���ְ�ɫ��������Һ�п��ܺ�������п������п���Ȼ�����Ӧ�������ᱵ�ǰ�ɫ������Ҳ���ܺ������������������Ȼ�����Ӧ�����Ȼ����ǰ�ɫ�������������ɫ����ֻ��֤��3����Һ�к�����������ӻ������ӣ��������ͬѧ��Ϊ3�ŵ��Һ�е�����һ��������п�Dz���ȷ�ģ�
��3����ɫ��������4��CuCl2+2AgNO3=2AgCl��+Cu��NO3��2����5��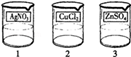
��3����ɫ��������4��CuCl2+2AgNO3=2AgCl��+Cu��NO3��2����5��

��1��2�ŵ��Һ�е��������������ͭ��������ͭ���Ȼ�����Ӧ�����ɰ�ɫ�����������ص�������ì�ܣ�������2�ŵ��Һ�е�����һ����������ͭ���ʴ�Ϊ����ȷ��
��2��3�ŵ��Һ�м����Ȼ�����Һ���ְ�ɫ��������Һ�п��ܺ�������п��Ҳ���ܺ�����������Ϊ����п���Ȼ�����Ӧ�������ᱵ�ǰ�ɫ���������������Ȼ�����Ӧ�����Ȼ����ǰ�ɫ�������ʴ�Ϊ������ȷ��3�ŵ��Һ�м����Ȼ�����Һ���ְ�ɫ��������Һ�п��ܺ�������п������п���Ȼ�����Ӧ�������ᱵ�ǰ�ɫ������Ҳ���ܺ������������������Ȼ�����Ӧ�����Ȼ����ǰ�ɫ�������������ɫ����ֻ��֤��3����Һ�к�����������ӻ������ӣ��������ͬѧ��Ϊ3�ŵ��Һ�е�����һ��������п�Dz���ȷ�ģ�
��3��������Ŀ�е�ʵ������2�ŵ��Һһ������ͭ���ӣ�3�ŵ��Һһ��������������ӣ�1�ŵ��Һ�ǿ��ܵ����Σ�������������2�ŵ��ҺΪ�Ȼ�ͭ��3�ŵ��ҺΪ����п��1�ŵ��Һ��������2�ŵ��Һ��ϣ������ɰ�ɫ�������ʴ�Ϊ����ɫ������
��4���Ȼ�ͭ���������������ֽⷴӦ����CuCl2+2AgNO3=2AgCl��+Cu��NO3��2���ʴ�Ϊ��CuCl2+2AgNO3=2AgCl��+Cu��NO3��2��
��5��1�ŵ��Һ������������2�ŵ��ҺΪ�Ȼ�ͭ��3�ŵ��ҺΪ����п���ʴ�Ϊ��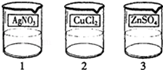 ��
��
��2��3�ŵ��Һ�м����Ȼ�����Һ���ְ�ɫ��������Һ�п��ܺ�������п��Ҳ���ܺ�����������Ϊ����п���Ȼ�����Ӧ�������ᱵ�ǰ�ɫ���������������Ȼ�����Ӧ�����Ȼ����ǰ�ɫ�������ʴ�Ϊ������ȷ��3�ŵ��Һ�м����Ȼ�����Һ���ְ�ɫ��������Һ�п��ܺ�������п������п���Ȼ�����Ӧ�������ᱵ�ǰ�ɫ������Ҳ���ܺ������������������Ȼ�����Ӧ�����Ȼ����ǰ�ɫ�������������ɫ����ֻ��֤��3����Һ�к�����������ӻ������ӣ��������ͬѧ��Ϊ3�ŵ��Һ�е�����һ��������п�Dz���ȷ�ģ�
��3��������Ŀ�е�ʵ������2�ŵ��Һһ������ͭ���ӣ�3�ŵ��Һһ��������������ӣ�1�ŵ��Һ�ǿ��ܵ����Σ�������������2�ŵ��ҺΪ�Ȼ�ͭ��3�ŵ��ҺΪ����п��1�ŵ��Һ��������2�ŵ��Һ��ϣ������ɰ�ɫ�������ʴ�Ϊ����ɫ������
��4���Ȼ�ͭ���������������ֽⷴӦ����CuCl2+2AgNO3=2AgCl��+Cu��NO3��2���ʴ�Ϊ��CuCl2+2AgNO3=2AgCl��+Cu��NO3��2��
��5��1�ŵ��Һ������������2�ŵ��ҺΪ�Ȼ�ͭ��3�ŵ��ҺΪ����п���ʴ�Ϊ��
 ��
��
��ϰ��ϵ�д�
 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
�����Ŀ

 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2