题目内容
【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究H2O2的浓度对化学反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30% H2O2的质量(g) | 加入的水的体积(mL) | MnO2质量(g) | 收集时间(s) |
① | 10 | 40 | 5 | 200 |
② | 20 | 30 | 5 | 100 |
③ | 30 | 20 | 67 |
①取用二氧化锰的实验仪器是 ;量取40mL水的实验仪器是 ;(填仪器名称)
②实验3中,加入的二氧化锰质量为 g。
③相同条件下,实验3产生氧气的速率最快,说明 。
(2)同学们想利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中H2O2的浓度为3%,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比.反应放热忽略不计.)
①图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 . 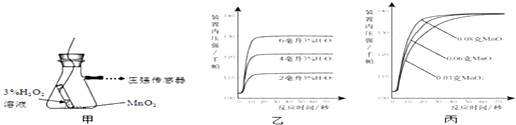
②当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线.曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求.在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图(选填字母)烧杯中所装的3%H2O2溶液,其分解速度最接近实验要求.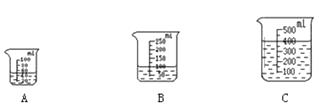
(3)同学通过查阅资料得知,常温下双氧水不易分解,但双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学们选择如上图示装置(气密性良好)进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是 , 同学分析原因后,采用了法收集气体,再检验,证明加热双氧水也可产生氧气。
【答案】
(1)药匙,量筒,5,相同条件下,反应物浓度越大,反应速率越快
(2)H2O2的用量越多,产生的O2越多,C
(3)氧气中混有较多的水蒸气,排水集气
【解析】(1) ① 取用粉末状药品用药匙,取用一定量液体用量筒和胶头滴管。②做对比实验一定要控制变量。③相同条件下,实验3产生氧气的速率最快,说明反应物的浓度越大反应速率越快;
(2) ①可以看出, H2O2的用量越多,产生的O2越多 ;②根据丙图分析,当MnO2的用量增加到0.08克时,在10~30秒内压强最大,即产生氧气最多,此时消耗了8毫升过氧化氢溶液,则当二氧化锰的质量是4克时消耗过氧化氢溶液的体积是400毫升,故选C;
(3)过氧化氢溶液中的溶剂是水,加热双氧水制取氧气,产生的氧气中含有水蒸气,使氧气的浓度降低而影响实验效果。用排水法收集时,氧气中的水蒸气遇冷变为水,使得氧气中水蒸气的含量降低,从而收集到更纯的氧气.
所以答案是:(1) 药匙;量筒;5;相同条件下,反应物浓度越大,反应速率越快;(2)H2O2的用量越多,产生的O2越多;C ;(3)氧气中混有较多的水蒸气;排水集气.
【考点精析】解答此题的关键在于理解氧气的收集方法的相关知识,掌握收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部,以及对催化剂的特点与催化作用的理解,了解催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案