��Ŀ����
����Ŀ����10�֣�����þ��һ��Ӧ�÷�Χ�dz��㷺������������������Ʊ���Ӳ�ȡ����ȵ�������ʴ����ĥ������µ�����Ԫ�صĵ�����Ʊ�������մɲ��ϵȡ�ijУ��ѧ�о�С����þ�뵪����Ӧ�Ʊ�����þ��Mg3N2��������ʵ�鷽���ⶨ����þ�Ĵ��ȡ�
I���Ʊ�����þ
���������ϡ�
��(NH4)2SO4+2NaNO2![]() 2N2��+Na2SO4+4H2O���÷�ӦΪ���ȷ�Ӧ��
2N2��+Na2SO4+4H2O���÷�ӦΪ���ȷ�Ӧ��
����������������Һ������������ϡ���������հ�����
���ڳ����»��¶Ȳ��ߵ�������þ������ˮ����Ӧ��
��ʵ�顿
�Ʊ�����þ��װ��ʾ��ͼ���£�
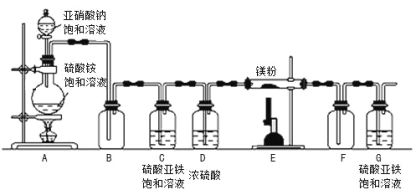
��1��Dװ�õ������� ��Gװ�õ������� ��
��2��Eװ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ��ʱ�Ƚ��� ��ѡ�A����E���������ȣ������� ��
II���ⶨ����þ�ĺ���
����þ��dz��ɫ��ĩ��������ˮ��Ӧ����Mg(OH)2������NH3����Ӧ�Ļ�ѧ����ʽΪ ������þ��Mg3N2���е�Ԫ�صĻ��ϼ��� ��
�����Է�����
����һ:ȡ��������þ��Ʒ���Թ��У�����������ˮ���Թܵײ��г������ɣ��Թܿ��ŵ��д̼�����ζ���������ɡ�
�����:��ȥ�ϲ���Һ������ϡ���ᣬ�۲쵽����ȫ����ð���ݡ��ò����в��������Ļ�ѧ����ʽΪ ��
�������ⶨ��
����ͼʵ��װ�ý���ʵ�飺
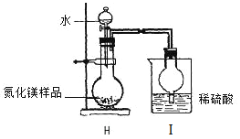
��4��ȡ����þ��Ʒ16g����ʵ�飬Iװ������3.4g�������Ʒ�е���þ��������������д��������̣���
��5�����θ���ܵ������� ��
���𰸡���1������ˮ����������ﵪ���� ��ֹ��������������Eװ��
��2��3Mg+N2![]() Mg3N2
Mg3N2
��3��A �ž�װ���ڵĿ��� �����չ�1�֣�Mg3N2 +6H2O==3Mg(OH)2+2NH3 ��
-3 Mg+2HCl==MgCl2+H2��
��4��62.5%��5����ַ�Ӧ����ֹ����
��������
�����������ʵ�顿��1��Dװ�õ��Լ�ΪŨ���ᣬ��������������ˮ����������ﵪ������Gװ�õ���������ֹ��������������Eװ�� ����2��Eװ���з�����Ӧ�Ļ�ѧ����ʽΪ��3Mg+N2![]() Mg3N2 ��3��ʵ��ʱ�Ƚ��е�ȼA ���ƾ��ƣ��� �ž�װ���ڵĿ��� ��II���ⶨ����þ�ĺ�������þ��dz��ɫ��ĩ��������ˮ��Ӧ����Mg(OH)2������NH3����Ӧ�Ļ�ѧ����ʽΪMg3N2 +6H2O==3Mg(OH)2+2NH3 �� �����ݻ�ѧʽ��Ԫ�ص��������ϼ۵Ĵ�����Ϊ��õ�����þ��Mg3N2���е�Ԫ�صĻ��ϼ� -3 �ۣ������Է�����:��ȥ�ϲ���Һ������ϡ���ᣬ�۲쵽����ȫ����ð���ݡ�˵��ǰ��ķ�Ӧ��ʣ�����þ���ʸò����в��������Ļ�ѧ����ʽMg+2HCl==MgCl2+H2�����������ⶨ��
Mg3N2 ��3��ʵ��ʱ�Ƚ��е�ȼA ���ƾ��ƣ��� �ž�װ���ڵĿ��� ��II���ⶨ����þ�ĺ�������þ��dz��ɫ��ĩ��������ˮ��Ӧ����Mg(OH)2������NH3����Ӧ�Ļ�ѧ����ʽΪMg3N2 +6H2O==3Mg(OH)2+2NH3 �� �����ݻ�ѧʽ��Ԫ�ص��������ϼ۵Ĵ�����Ϊ��õ�����þ��Mg3N2���е�Ԫ�صĻ��ϼ� -3 �ۣ������Է�����:��ȥ�ϲ���Һ������ϡ���ᣬ�۲쵽����ȫ����ð���ݡ�˵��ǰ��ķ�Ӧ��ʣ�����þ���ʸò����в��������Ļ�ѧ����ʽMg+2HCl==MgCl2+H2�����������ⶨ��
��4���⣺����Ʒ�е���þ������Ϊx
Mg3N2 +6H2O==3Mg(OH)2+2NH3 �� �� Mg3N2 �� 2NH3
100 34 100 34
X 3.4g X 3.4g
![]()
X=10g(1��)
Mg3N2=![]() ��1�֣�
��1�֣�
����Ʒ�е���þ����������Ϊ62.5%
��5�����θ���ܵ���������ַ�Ӧ����ֹ����