题目内容
【题目】将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是
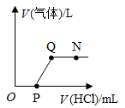
A.N点时,所得溶液的pH=7
B.Q点时,所得溶液中的溶质只含有BaCl2
C.O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O
D.P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O
【答案】C
【解析】
试题分析:从图示看:原来的反应物中二者恰好反应会生成氢氧化钠和碳酸钡,所以开始加入盐酸后没有立即产生气体,而是盐酸先和氢氧化钠反应,O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O;当Q点后碳酸钡和氢氧化钡都恰好反应完,P至Q段发生反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2 ↑;Q点时,所得溶液中的溶质只含有BaCl2和NaCl;所以此时的PH值为7,但是N点是盐酸过量,所以此时的PH值是小于7。故选C.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目