题目内容
【题目】以黄铜矿为原料,采用生物炼铜是现代炼钢的新工艺,其原理为:
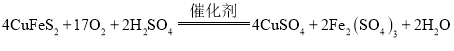 ,通过进一步的处理便可得到Cu。若要得到80kg硫酸铜,试计算:(已知:相对分子质量为CuFeS2-184 H2SO4-98 CuSO4-160)
,通过进一步的处理便可得到Cu。若要得到80kg硫酸铜,试计算:(已知:相对分子质量为CuFeS2-184 H2SO4-98 CuSO4-160)
(1)CuSO4中氧元素的质量分数是硫元素质量分数的_____倍。
(2)若加入的质量分数为12.25%的稀硫酸恰好参与反应,则加入稀硫酸的质量是多少?
(3)上述过程中,所得溶液中硫酸铜的质量分数是多少?(计算结果精确到0.1%)。
【答案】(1)2(2)200kg(3)22.2%
【解析】
(1)CuSO4中氧元素、硫元素的质量比为:(16×4):32=2:1,故CuSO4中氧元素的质量分数是硫元素质量分数的2倍。
(2)设要得到80kg硫酸铜,若加入的质量分数为12.25%的稀硫酸恰好参与反应,加入稀硫酸的质量是x。

![]()
![]() ,解得x=200kg
,解得x=200kg
(3)设生成80kg硫酸铜消耗CuFeS2的质量为m,消耗O2的质量为n。

![]() ,解得m=92kg
,解得m=92kg
![]() ,解得n=68kg
,解得n=68kg
根据质量守恒定律,反应后所得溶液的质量为:92kg+68kg+200kg=360kg
所得溶液中硫酸铜的质量分数是:![]() ≈22.2%
≈22.2%

练习册系列答案
相关题目