题目内容
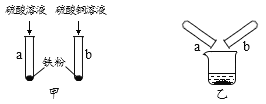
【题目】为探究铁的化学性质,某学习小组做了如图甲所示实验。他们观察到试管a中铁粉全部溶解,产生大量气泡,溶液呈①____色,反应的化学方程式为②____;试管b中有③______色固体生成,该反应的化学方程式为④_____。为进一步确定试管a所得溶液中的溶质成分和试管b所得固体的组成,他们进行了以下实验探究。
(提出猜想)(1)试管a中的溶质成分:猜想一:FeSO4;猜想二:⑤______。
(2)试管b中固体的组成:猜想三:Cu; 猜想四:Fe和Cu。
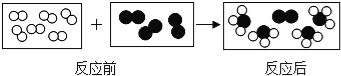
(实验探究)甲图所示实验结束后,将试管a、试管b内的物质全部倒入同一烧杯中(如乙图所示),他们惊奇地发现烧杯内溶液中产生大量气泡。
(总结交流)经过讨论,大家一致认为上述猜想中正确的是⑥_______。
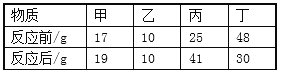
(拓展探究)某混合溶液由硫酸铜和硫酸溶液组成。上述小组同学取192.4g该混合溶液于烧杯中,然后往其中加入33.6g铁粉,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(3)原混合溶液中H2SO4的质量______。(计算结果保留一位小数)
(4)原混合溶液中CuSO4和H2SO4的质量比______。
(5)完全反应后所得溶液中溶质的质量分数_______。(计算结果保留一位小数)
【答案】浅绿 Fe+H2SO4=FeSO4+H2↑ 红 Fe+CuSO4=FeSO4+Cu H2SO4和FeSO4 猜想二和猜想四 19.6g 160:49 45.6%
【解析】
铁和硫酸反应生成氢气和硫酸亚铁,观察到试管a中铁粉全部溶解,产生大量气泡,溶液呈 绿色,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;试管b中是铁和硫酸铜反应生成铜和硫酸亚铁,有红色固体生成,该反应的化学方程式为 Fe+CuSO4=FeSO4+Cu;
提出猜想:(1)试管a中的溶质成分:猜想一为铁和硫酸恰好反应,无硫酸剩余,所以溶质只有FeSO4;猜想二为硫酸过量,溶质为剩余的H2SO4和生成的FeSO4;
总结交流:甲图所示实验结束后,将试管a、试管b内的物质全部倒入同一烧杯中,发现烧杯内溶液中产生大量气泡。说明是铁和硫酸反应生成氢气,所以是有铁剩余和硫酸剩余的情况,对应的正确猜想为猜想二和猜想四;
设:溶液中H2SO4的质量为x,生成的硫酸亚铁的质量为y,消耗的铁的质量为z。
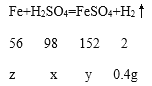
![]() x=19.6g
x=19.6g
![]() y=30.4g
y=30.4g
![]() z=11.2g
z=11.2g
则与硫酸铜反应的铁的质量为33.6g﹣11.2g=22.4g;
设:硫酸铜的质量为a,生成的铜的质量为b,生成的硫酸亚铁的质量为c。
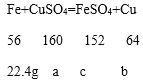
![]() a=64g
a=64g
![]() b=25.6g
b=25.6g
![]() c=60.8g
c=60.8g
原混合溶液中CuSO4和H2SO4的质量比64g :19.6g =160:49;
完全反应后所得溶液中溶质的质量分数 ![]() 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案