题目内容
氢化钙(CaH2)固体是一种储氢材料,登山运动员常用其作能源提供剂。
【查阅资料】
①碱石灰是氧化钙和氢氧化钠的固体混合物.
②钙和氢化钙都能与水反应,均生成氢氧化钙和氢气.
【氢化钙的制备】
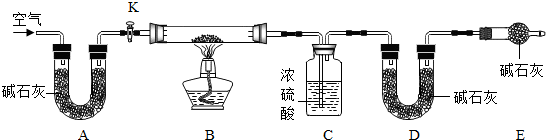
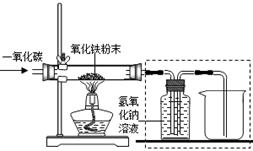
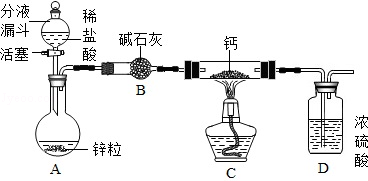
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图所示(图中固定装置省略).
(1)装置A中制取氢气反应的化学方程式是 .
(2)装置B的作用是 .
(3)装置D的作用是 .
(4)装置C中制取氢化钙的化学方程式是 .
【样品成分的猜想】通过上述方法制得的氢化钙样品的成分有下列两种猜想:
猜想一:全部是氢化钙; 猜想二: .
【设计实验】现有2.1g氢化钙样品,请设计实验验证猜想二是否成立 (要求操作、数据和结论).

【查阅资料】
①碱石灰是氧化钙和氢氧化钠的固体混合物.
②钙和氢化钙都能与水反应,均生成氢氧化钙和氢气.
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图所示(图中固定装置省略).
(1)装置A中制取氢气反应的化学方程式是 .
(2)装置B的作用是 .
(3)装置D的作用是 .
(4)装置C中制取氢化钙的化学方程式是 .
【样品成分的猜想】通过上述方法制得的氢化钙样品的成分有下列两种猜想:
猜想一:全部是氢化钙; 猜想二: .
【设计实验】现有2.1g氢化钙样品,请设计实验验证猜想二是否成立 (要求操作、数据和结论).
(1)Zn+2HCl=ZnCl2+H2↑;(2)吸收水蒸气和氯化氢气体;(3)吸收空气中的水蒸气,防止空气中的水蒸气进入,与钙反应;(4)Ca+H2 CaH2 ;猜想二:氢化钙和钙;【设计实验】取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.
CaH2 ;猜想二:氢化钙和钙;【设计实验】取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.
 CaH2 ;猜想二:氢化钙和钙;【设计实验】取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.
CaH2 ;猜想二:氢化钙和钙;【设计实验】取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.试题分析:(1)反应物是锌和盐酸写在等号的左边,生成物是氯化锌和氢气,写在等号的右边,用观察法配平,所以方程式是:Zn+2HCl=ZnCl2+H2↑;(2)碱石灰能与盐酸反应,也能与水反应,所以碱石灰作用是吸收水蒸气和氯化氢气体;(3)浓硫酸具有吸水性,能吸收空气中水蒸气,防止空气中的水蒸气进入,与钙反应;(4)反应物是钙和氢气写在等号的左边,生成物是氢化钙写在等号的右边,反应条件是加热,所以方程式是:Ca+H2
 CaH2;由于钙也是固体,如果钙过量了,氢化钙中会混有钙;设2.1g全部是氢化钙生成氢气质量为X则:
CaH2;由于钙也是固体,如果钙过量了,氢化钙中会混有钙;设2.1g全部是氢化钙生成氢气质量为X则:CaH2+2H2O═Ca(OH)2+2H2↑,
42 4
2.1g X
根据
 解得X=0.2g,所以取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.
解得X=0.2g,所以取2.1 g样品与足量水反应,收集反应生成的氢气,若生成的氢气质量等于0.2 g,则猜想二不成立;若生成气体的质量小于0.2 g,则猜想二成立.
练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目