题目内容
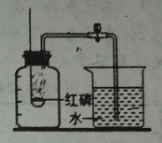
【题目】甲、乙是实验室制备CO2和某同学设计的验证CO2性质的实验装置图。
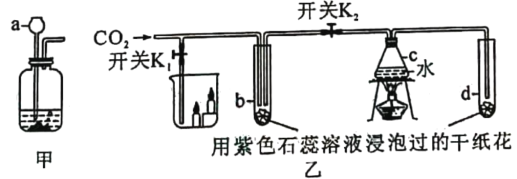
(1)仪器a在使用时应该_____.
(2)甲中发生反应的化学方程式是_____。
(3)乙中进行实验时,先关闭K1和K2,加热C一段时间后再通入CO2,观察到b、d中纸花均_____。再打开K2,b中纸花逐渐变_____,由此证明_____。
(4)若打开K1,还可以证明CO2具有的性质是_____。
【答案】漏斗下端深入液面下(或液封) CaCO3+2HCl=CaCl2+H2O+CO2↑ 不变色 红 CO2+H2O=H2CO3,碳酸显酸性使石蕊变红 密度大于空气,不可燃不支持燃烧
【解析】
(1)为了防止生成的气体从长颈漏斗跑掉,故使用仪器a是,长颈漏斗的下端要没入液面以下。
(2)甲装置中的反应是碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)先关闭K1和K2时,b中的干燥小花没有与水接触,只有二氧化碳接触,故不变色,d中的干燥小花即没有接触水,又没有接触二氧化碳,故也不变色。当打开K2后,c中的水蒸气遇二氧化碳一起进入到d中,d中的小花变红。由以上实验可以说明二氧化碳与水反应生成了碳酸,反应可表示为:CO2+H2O=H2CO3
(4)若打开K1,a装置中的蜡烛由低到高依次熄灭,故还可以证明CO2具有的性质是密度大于空气,不可燃不支持燃烧。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目