题目内容
100g稀硫酸恰好能跟50g 16%的氢氧化钠溶液完全中和,求:
(1)稀硫酸中溶质的质量分数.
(2)反应后所得硫酸钠溶液中溶质的质量分数.
解:设参加反应的纯硫酸的质量为x,生成的硫酸钠的质量为y
2NaOH+H2SO4═Na2SO4 +2H2O
80 98 142
50g×16% x y
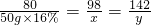
解得:x=9.8g
y=14.2g
(1)稀硫酸中溶质的质量分数为: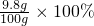 =9.8%;
=9.8%;
(2)反应后所得硫酸钠溶液中溶质的质量分数为: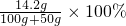 ≈9.5%
≈9.5%
答:(1)稀硫酸中溶质的质量分数为9.8%;
(2)反应后所得硫酸钠溶液中溶质的质量分数为9.5%.
分析:根据反应的化学方程式进行计算,求出参加反应的纯硫酸的质量和生成的硫酸钠的质量,然后根据溶质质量分数公式求出溶液的溶质质量分数.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据已有的知识进行.
2NaOH+H2SO4═Na2SO4 +2H2O
80 98 142
50g×16% x y
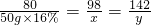
解得:x=9.8g
y=14.2g
(1)稀硫酸中溶质的质量分数为:
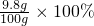 =9.8%;
=9.8%;(2)反应后所得硫酸钠溶液中溶质的质量分数为:
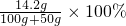 ≈9.5%
≈9.5%答:(1)稀硫酸中溶质的质量分数为9.8%;
(2)反应后所得硫酸钠溶液中溶质的质量分数为9.5%.
分析:根据反应的化学方程式进行计算,求出参加反应的纯硫酸的质量和生成的硫酸钠的质量,然后根据溶质质量分数公式求出溶液的溶质质量分数.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目