题目内容
(2013黑龙江大兴安岭)学完酸碱盐知识后,小美对妈妈焙制糕点用的小苏打很感兴趣,她把小苏打带到实验室与小刚一起进行探究。
(1)小美取少量小苏打溶于水,滴加酚酞试液后,溶液变红,说明小苏打的水溶液显 性;
(2)小刚在烧杯内放入少量小苏打,向其中滴加稀盐酸,立即有 产生,说明小苏打能与酸反应.在医疗上可以用小苏打治疗 ;
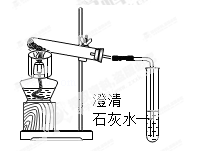
(3)小美想:糕点非常松软,是不是小苏打受热分解产生了CO2气体呢?于是她如图装置对小苏打进行加热,一段时间后,导管口的确有气泡冒出,澄清石灰水变浑浊,同时试管口有水珠生成.当导管口不再有气泡产生时,试管内仍有白色固体,她猜测剩余固体可能是:①NaOH;②Na2CO3;③NaCl.小刚认为猜想 一定不正确,理由是 。小刚从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,他判断该固体为NaOH,小美认为他的实验设计不合理,因为 。
(4)小美和小刚继续探究固体成分,设计了如下实验:
通过实验证明小苏打受热会分解,反应的化学方程式为: 。通过本次探究学习,小美对小苏打的性质有了全面的认识,她给妈妈提出保存小苏打的建议有: (答出一点即可)。
(1)小美取少量小苏打溶于水,滴加酚酞试液后,溶液变红,说明小苏打的水溶液显 性;
(2)小刚在烧杯内放入少量小苏打,向其中滴加稀盐酸,立即有 产生,说明小苏打能与酸反应.在医疗上可以用小苏打治疗 ;
(3)小美想:糕点非常松软,是不是小苏打受热分解产生了CO2气体呢?于是她如图装置对小苏打进行加热,一段时间后,导管口的确有气泡冒出,澄清石灰水变浑浊,同时试管口有水珠生成.当导管口不再有气泡产生时,试管内仍有白色固体,她猜测剩余固体可能是:①NaOH;②Na2CO3;③NaCl.小刚认为猜想 一定不正确,理由是 。小刚从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,他判断该固体为NaOH,小美认为他的实验设计不合理,因为 。

(4)小美和小刚继续探究固体成分,设计了如下实验:
| 操作步骤 | 实验现象 | 结论 |
| 取少量白色固体于试管中,加水溶解,向其中滴加 溶液 | 产生白色沉淀 | 试管内剩余的固体为Na2CO3 |
⑴碱;(2)气体;胃酸过多症;(3) ③;小苏打中不含氯元素;碳酸钠溶液也可以使酚酞变红;
(4)
NaHC03 Na2C03 + H20+C02↑;密封保存
Na2C03 + H20+C02↑;密封保存
(4)
| 操作步骤 | 实验现象 | 结论 |
| 取少量白色固体于试管中,加水溶解,向其中滴加氯化钙溶液 | 产生白色沉淀 | 试管内剩余的固体为Na2CO3 |
NaHC03
 Na2C03 + H20+C02↑;密封保存
Na2C03 + H20+C02↑;密封保存试题分析:(1)酚酸遇碱性溶液会变红,所以可以根据题中信息可以知道小苏打的水溶液呈碱性;
(2)小苏打可以和盐酸反应生成二氧化碳气体,人体胃液中含有盐酸,若盐酸过多则会造成胃酸过多症而引起不适,所以可以利用小苏打能够和盐酸反应且无毒的性质来治疗胃酸过多症;
(3)根据质量守恒定律及化学反应的实质可以知道反应前后元素的种类不变,反应小苏打中没有氢元素,所以反应后剩余的物质不可能为氯化钠,即猜想③不正确;碳酸钠溶液呈碱性,可以使酚酞变红,所以不能根据溶液变红就判断该物质为氢氧化钠.
(4)碳酸钠溶液可以和氯化钙溶液反应生成沉淀,而氢氧化钠和盐酸反应没有明显现象,所以若取少量白色固体于试管中,加水溶解,向其中滴加氯化钙溶液,若观察到生成了白色沉淀,则说明该白色固体为碳酸钠.即反应生成了二氧化碳、水和碳酸钠,该反应的化学方程式为:NaHC03
 Na2C03 + H20+C02↑;小苏打能够溶于水,所以应该保存干燥,即密封保存。
Na2C03 + H20+C02↑;小苏打能够溶于水,所以应该保存干燥,即密封保存。
练习册系列答案
相关题目