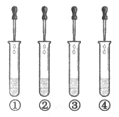
题目内容
实验室有一种澄清的废液中可能含有Na2CO3、NaOH、Ca(OH)2、BaCl2中的一种或几种物质,为了证明其成分,进行了如下的探究活动。

【提出问题】废液中含有哪些溶质?
【进行实验1】
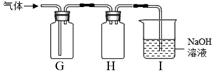
甲同学取样:
【表达交流】 由此证明溶液中一定没有(1) ;
【进行实验2】乙同学再取样,向废液中通入二氧化碳气体,观察到废液中出现白色浑浊,由此乙同学得出的结论废液中一定含有Ca(OH)2。
【表达交流】请你对乙同学的结论做出评价:(2) ;
【进行实验3】甲同学再取少量废液加入一定量的(3) ,若观察到(4) ,证明乙同学的结论正确
【反思与评价】废液中通入二氧化碳后可能发生的化学反应方程式为:(5) 。

【提出问题】废液中含有哪些溶质?
【进行实验1】
甲同学取样:
【表达交流】 由此证明溶液中一定没有(1) ;
【进行实验2】乙同学再取样,向废液中通入二氧化碳气体,观察到废液中出现白色浑浊,由此乙同学得出的结论废液中一定含有Ca(OH)2。
【表达交流】请你对乙同学的结论做出评价:(2) ;
【进行实验3】甲同学再取少量废液加入一定量的(3) ,若观察到(4) ,证明乙同学的结论正确
【反思与评价】废液中通入二氧化碳后可能发生的化学反应方程式为:(5) 。
(1)Na2CO3; (2)不正确;废液中同时含有NaOH 和 BaCl2通入二氧化碳后,二氧化碳在溶液中先与NaOH反应生成碳酸钠,碳酸钠与氯化钡反应生成碳酸钡沉淀,因此不一定含有Ca(OH)2;
(3)稀硫酸 (4)无明显变化 (5)CO2 + 2NaOH = Na2CO3 +H2O
(3)稀硫酸 (4)无明显变化 (5)CO2 + 2NaOH = Na2CO3 +H2O
试题分析:【进行实验1】【表达交流】盐酸能和碳酸钠反应生成二氧化碳气体,所以滴加稀盐酸没有明显现象,说明溶液中一定没有Na2CO3;
【进行实验2】【表达交流】废液中同时含有NaOH 和 BaCl2通入二氧化碳后,二氧化碳在溶液中先与NaOH反应生成碳酸钠,碳酸钠与氯化钡反应生成碳酸钡沉淀,所以不一定含有Ca(OH)2;
【进行实验3】硫酸能和氯化钡反应生成硫酸钡沉淀,所以再取少量废液加入一定量的稀硫酸,若观察到无明显变化,证明乙同学的结论正确;
【反思与评价】废液中可能含有氢氧化钠,所以废液中通入二氧化碳后可能发生的化学反应方程式为CO2+2NaOH═Na2CO3+H2O。

练习册系列答案
相关题目

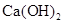 溶液、Na2CO3溶液中的一种。请你将它们区分出来,并完成下面的实验报告。
溶液、Na2CO3溶液中的一种。请你将它们区分出来,并完成下面的实验报告。