题目内容
【题目】在密闭容器中有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是
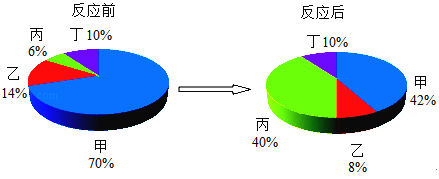
A.丙一定是化合物
B.该反应一定是分解反应
C.丁在该反应中一定是催化剂
D.生成丙的质量一定等于反应前的甲和乙的质量之和
【答案】A
【解析】
由四种物质反应前后各物质的质量分数可知,反应前、后甲的质量分数减少了70%-42%=28%,故甲是反应物;同理可以确定乙的质量分数减少了14%-8%=6%,故乙是反应物;丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
A、该反应的反应物为甲和乙,生成物是丙,该反应是由两种物质生成一种物质的反应,属于化合反应,丙一定是化合物,故A正确;
B、该反应的反应物为甲和乙,生成物是丙,该反应是由两种物质生成一种物质的反应,属于化合反应,故B错误;
C、丁的质量分数不变,可能没有参加反应,也可能作该反应的催化剂,故C错误;
D、根据质量守恒定律,生成丙的质量一定等于参加反应的甲、乙的质量之和,不等于反应前的甲和乙的质量之和,故D错误。故选A。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
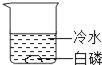
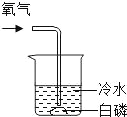
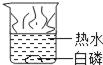
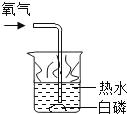
暑假衔接培优教材浙江工商大学出版社系列答案【题目】通常情况下,燃烧需要三个条件,如图所示的实验中,能证明可燃物燃烧与温度有关的是( )
实验① | 实验② | 实验③ | 实验④ |
|
|
|
|
白磷不燃烧 | 白磷不燃烧 | 白磷不燃烧 | 白磷燃烧 |
A. ②④ B. ②③ C. ①③ D. ①④
【题目】某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究活动,并填空:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了两组对比实验:
I将3.0g氯酸钾和0.5 g二氧化锰粉末均匀混合加热
II将3.0g氯酸钾和Xg氧化铜粉末均匀混合加热
①在相同条件下比较上述两组实验产生氧气的快慢,实验II中X的值应为___________。
②若氧化铜可以催化氯酸钾分解,写出反应的化学方程式____________。
(2)乙同学探究“红砖粉末是否也可以作为过氧化氢分解的催化剂”。
[提出问题]红砖粉末能不能做“过氧化氢分解”的催化剂呢?
[做出猜想]红砖粉末能做“过氧化氢分解”的催化剂。
[实验验证]
实验步骤 | 实验现象 | 实验结论 |
①将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢分解速率很慢 |
②在上述试管中加入0.2g红砖粉末,然后将带火星的木条伸入试管中 | 木条复燃 | ①__________________, |
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管 | 在化学反应前后,红砖粉末的②____________没有改变。 |
[实验讨论]
有同学认为:仅凭上述实验还不能证明红砖粉末能做过氧化氢分解的催化剂,还需要增加一个实验。 将实验后剩余固体提纯后称量,如果所得固体的质量等于0.2g,则说明红砖粉末可以作为过氧化氢分解的催化剂。
[实验拓展]查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是____________(填字母)。
A催化剂能增加生成物的量
B在工业生产中催化剂起到极大的作用
C催化剂只能加快化学反应的速率
D同一个化学反应可以有多种催化剂