题目内容
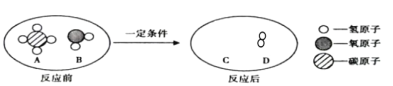
【题目】A、B、C、D、E 是初中常见的五种物质,都含有相同元素。已知 A、B、C、D 是不同类别的物质,A 的相对分子质量小于B,B能用于金属除锈,C用于制造洗涤剂,这些物质或其溶液能发生如图反应,“—”表示物质间能发生反应,“→”表示物质间可以转化。
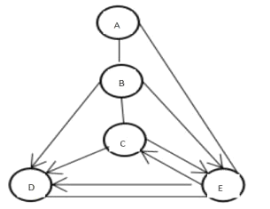
(1)写出化学式:C___________、E__________
(2)A、E反应会看到明显的实验现象,写出此反应的化学方程式__________ 。
(3)写出足量B和固体C反应的实验现象__________
【答案】Na2CO3 CO2 CO2+Ca(OH)2=CaCO3↓+H2O 固体逐渐减少至消失,同时有气泡冒出
【解析】
根据A、B、C、D、E 是初中常见的五种物质,都含有相同元素,B能用于金属除锈,C用于制造洗涤剂,所以B是硫酸,C是碳酸钠;碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠,所以E是二氧化碳;A能与二氧化碳、稀硫酸反应,且A的相对分子质量小于B,根据(2)A、E反应会看到明显的实验现象,所以A是氢氧化钙;B、C、E都能转化生成D,D是水,经验证推断正确。
(1)根据分析,C是碳酸钠,化学式是:Na2CO3;E是二氧化碳,化学式是:CO2;
(2)因为A、E反应会看到明显的实验现象,根据分析该反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)根据分析,B是硫酸,C是碳酸钠,足量的稀硫酸和碳酸钠反应生成二氧化碳气体,故反应的实验现象是:固体逐渐减少至消失,同时有气泡冒出。

【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。某兴趣小组对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
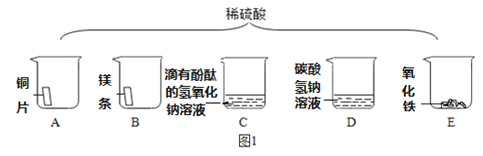
(探究一)硫酸的性质
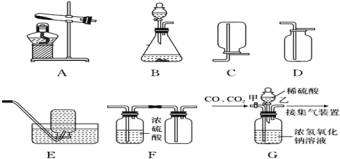
(1)如图1将足量的稀硫酸分别加入A~E五只烧杯中。无现象的是_____________(填序号)。
(2)烧杯C中的现象是红色褪去,反应后溶液中溶质是什么呢?(无色酚酞不考虑)
(猜想)猜想一:只有Na2SO4 ; 猜想二:有_________________;
(3)为了验证猜想,小组同学取烧杯中的溶液,并选用老师提供的pH试纸、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,比照比色卡,pH<7 | ____________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,小组同学一致确定猜想二是正确的。
(评价反思)老师指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
①实验操作中明显的一处错误是_________________________________________;
②实验探究方案中也有一个是不合理的,不合理的原因是____________________________。
(探究二)硫酸的工业制法
工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程如图所示,其中沸腾炉内发生的主
要反应是: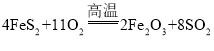

(1)接触室中发生的化学方程式为_________________________________________。
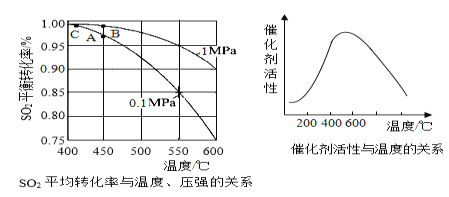
(2)接触室中的SO2平衡转化率与温度及压强的关系如下图所示,催化剂活性与温度的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的C点对应的反应条件,其原因是___________________________________。
(探究三)探究某黄铁矿中FeS2的含量。
(查阅资料)![]()
(实验探究)Ⅰ称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应(同工业上沸腾炉内的反应)。

Ⅱ反应结束后,将乙瓶中的溶液进行如下图处理。

(问题讨论)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____________________。
(含量测定)计算该黄铁矿中FeS2的质量分数为_______________。(写出计算过程)