题目内容
(2012?大兴区二模)金属材料在生活、生产中应用十分广泛.
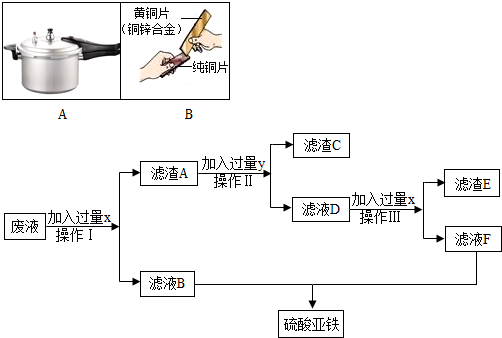
(1)图A是金属的一个应用实例,其利用金属的主要性质是
(2)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式
(3)某兴趣小组同学欲从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,设计流程如图所示.
加入的γ是

(1)图A是金属的一个应用实例,其利用金属的主要性质是
导热性
导热性
;图B是两块金属片相互刻划后,在纯铜片上有明显的划痕.由此可得到的结论是黄铜比纯铜的硬度大
黄铜比纯铜的硬度大
.(2)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(3)某兴趣小组同学欲从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,设计流程如图所示.
加入的γ是
稀硫酸
稀硫酸
;写出上述有关反应的化学方程式Fe+H2SO4═FeSO4+H2↑;Fe+CuSO4═FeSO4+Cu
Fe+H2SO4═FeSO4+H2↑;Fe+CuSO4═FeSO4+Cu
.分析:(1)从金属的用途反应其性质的角度和合金的性质的角度分析;
(2)从化学方程式书写角度分析;
(3)从图中各物质的化学性质进行分析.
(2)从化学方程式书写角度分析;
(3)从图中各物质的化学性质进行分析.
解答:解:(1)金属的用途反应其性质,饭锅主要是利用了金属的导电性.黄铜片是铜的合金,硬度比铜大,当黄铜片(铜锌合金)与铜片互相刻划时,在铜片的表面可留下划痕.故答案为:导热性;黄铜比纯铜的硬度大
(2)一氧化碳与赤铁矿冶炼生铁的反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,反应条件是高温.故答案为:Fe2O3+3CO
2Fe+3CO2
(3)从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,应先把硫酸和硫酸铜转变成硫酸亚铁,故加入的x是铁;滤渣A是过量的铁和铜,把铁转化成硫酸亚铁需加过量的稀硫酸;滤液D中过量的稀硫酸转化成硫酸亚铁又需加入铁,最好蒸发滤液B和滤液F便可得到硫酸亚铁.故答案为:稀硫酸;Fe+H2SO4═FeSO4+H2↑ Fe+CuSO4═FeSO4+Cu
(2)一氧化碳与赤铁矿冶炼生铁的反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,反应条件是高温.故答案为:Fe2O3+3CO
| ||
(3)从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,应先把硫酸和硫酸铜转变成硫酸亚铁,故加入的x是铁;滤渣A是过量的铁和铜,把铁转化成硫酸亚铁需加过量的稀硫酸;滤液D中过量的稀硫酸转化成硫酸亚铁又需加入铁,最好蒸发滤液B和滤液F便可得到硫酸亚铁.故答案为:稀硫酸;Fe+H2SO4═FeSO4+H2↑ Fe+CuSO4═FeSO4+Cu
点评:本题重点考查了金属的性质用途、合金的性质、化学方程式书写以及实验操作过程的推断.

练习册系列答案
相关题目
 (2012?大兴区二模)往如图所示的烧杯中加入一种物质,搅拌后,发现塑料片滑落.加入的物质不可能是( )
(2012?大兴区二模)往如图所示的烧杯中加入一种物质,搅拌后,发现塑料片滑落.加入的物质不可能是( ) (2012?大兴区二模)经测定,甲、乙、丙、丁四条河流的pH如图所示,则河水呈碱性的是pH( )
(2012?大兴区二模)经测定,甲、乙、丙、丁四条河流的pH如图所示,则河水呈碱性的是pH( )