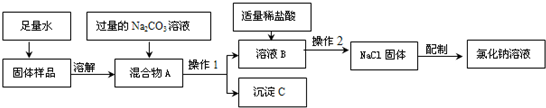
题目内容
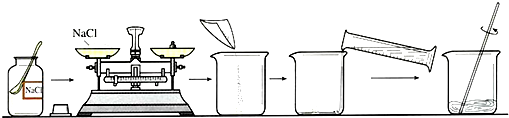
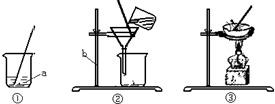
海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐,经提纯后可得到纯净的NaCl.如图是粗盐提纯的实验操作: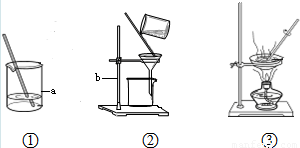
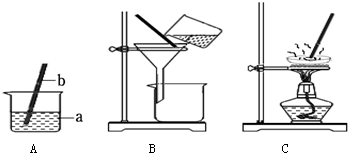
(1)上图有标号的仪器名称分别是a______,b______.
(2)从上图中可知,粗盐提纯的实验操作步骤是:______、______、______.
(3)在操作②中,玻璃棒的作用是______;在操作③中,当看到蒸发皿中出现______时,停止加热.
(4)若称取经过提纯后的NaCl固体5.0g,则可配制出溶质质量分数为10%的NaCl溶液的质量为______g.
【答案】分析:(1)根据认识的实验仪器名称答题即可;
(2)先写出粗盐提纯的步骤,据此解答即可;
(3)根据实验过程的要求和实验现象分析解答;
(4)根据溶质质量分数公式进行计算即可.
解答:解:(1)a仪器的名称是烧杯,b仪器的名称是铁架台.
故答案为:烧杯,铁架台.
(2)粗盐提纯的步骤为:①把含有泥沙的粗食盐完全溶解;
②过滤掉不溶于水的泥沙;
③蒸发掉水分,即得到氯化钠晶体.
故答案为:溶解,过滤,蒸发.
(3)在操作②中,玻璃棒的作用主要是使溶液顺着玻璃棒流入漏斗中;
在操作③中,当看到蒸发皿中出现较多固体时,说明水分已被蒸干,应停止加热.
故答案为:引流、较多固体.
(4)5.0g÷10%=50g.
故答案为:50.
点评:本题主要考查学生对粗盐提纯的实验操作步骤的熟练程度,以及运用溶质质量分数公式进行计算的能力.
(2)先写出粗盐提纯的步骤,据此解答即可;
(3)根据实验过程的要求和实验现象分析解答;
(4)根据溶质质量分数公式进行计算即可.
解答:解:(1)a仪器的名称是烧杯,b仪器的名称是铁架台.
故答案为:烧杯,铁架台.
(2)粗盐提纯的步骤为:①把含有泥沙的粗食盐完全溶解;
②过滤掉不溶于水的泥沙;
③蒸发掉水分,即得到氯化钠晶体.
故答案为:溶解,过滤,蒸发.
(3)在操作②中,玻璃棒的作用主要是使溶液顺着玻璃棒流入漏斗中;
在操作③中,当看到蒸发皿中出现较多固体时,说明水分已被蒸干,应停止加热.
故答案为:引流、较多固体.
(4)5.0g÷10%=50g.
故答案为:50.
点评:本题主要考查学生对粗盐提纯的实验操作步骤的熟练程度,以及运用溶质质量分数公式进行计算的能力.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目

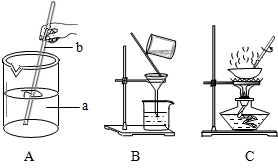 (1)海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.在做粗盐初步提纯的实验时,要进行如下图所示的实验操作.
(1)海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.在做粗盐初步提纯的实验时,要进行如下图所示的实验操作.
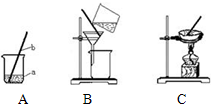 (1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.
(1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.