题目内容
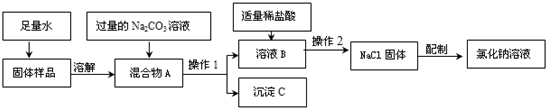
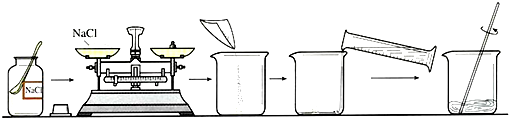
23、海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.为了得到纯净的NaCl(不考虑可溶性杂质),设计了如图所示的实验操作:

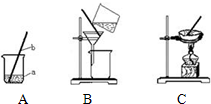
(1)上图有标号的仪器名称分别是a
(2)操作②中玻璃棒的作用是
(3)操作③中看到
(4)称取5.0gNaCl固体,可配制溶质质量分数为10%NaCl溶液

(1)上图有标号的仪器名称分别是a
烧杯
,b铁架台
.(2)操作②中玻璃棒的作用是
引流
.(3)操作③中看到
蒸发皿中出现较多固体
时,停止加热.(4)称取5.0gNaCl固体,可配制溶质质量分数为10%NaCl溶液
50
g.分析:粗盐提纯含有少量泥沙的粗盐,正确步骤为溶解、过滤、蒸发、计算产率.①粗盐逐渐加入盛有水的烧杯中边加边用玻璃棒搅拌,直到溶解;②过滤时注意“一贴,二低,三靠”;③蒸发时,注意用玻璃棒不断搅拌,以防液滴飞溅;待蒸发皿中出现较多固体时,停止加热,利用蒸发皿余热使滤液蒸干;④计算产率,将提纯后的氯化钠与粗盐作比较,并计算精盐的产率.
解答:解:用海水晒盐得到的是粗盐.提纯含有少量泥沙的粗盐,正确步骤为溶解、过滤、蒸发计算产率.
(1)根据图形写仪器名称;
(2)粗盐提纯含有少量泥沙的粗盐,正确步骤为溶解、过滤、蒸发、计算产率;操作②是过滤,过滤该食盐水.待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色,如滤液仍浑浊,应该再过滤一次,玻璃棒的作用是引流;
(3)蒸发时,注意用玻璃棒不断搅拌,以防液滴飞溅;待蒸发皿中出现较多固体时,停止加热,利用蒸发皿余热使滤液蒸干;
(4)溶液中溶质质量5.0g,溶质质量分数为10%,则溶液质量为:5.0克÷10%=50g.
故答案为:
(1)烧杯,铁架台;
(2)过滤,引流;
(3)蒸发皿中出现较多固体;
(4)50.
(1)根据图形写仪器名称;
(2)粗盐提纯含有少量泥沙的粗盐,正确步骤为溶解、过滤、蒸发、计算产率;操作②是过滤,过滤该食盐水.待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色,如滤液仍浑浊,应该再过滤一次,玻璃棒的作用是引流;
(3)蒸发时,注意用玻璃棒不断搅拌,以防液滴飞溅;待蒸发皿中出现较多固体时,停止加热,利用蒸发皿余热使滤液蒸干;
(4)溶液中溶质质量5.0g,溶质质量分数为10%,则溶液质量为:5.0克÷10%=50g.
故答案为:
(1)烧杯,铁架台;
(2)过滤,引流;
(3)蒸发皿中出现较多固体;
(4)50.
点评:注意混合物的分离方法,探究实验操作的注意事项,熟练常用仪器的名称和选用,加强溶质质量分数的简单计算.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目

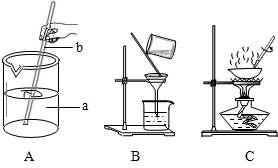 (1)海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.在做粗盐初步提纯的实验时,要进行如下图所示的实验操作.
(1)海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.在做粗盐初步提纯的实验时,要进行如下图所示的实验操作.
 (1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.
(1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.