题目内容
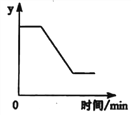
【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入溶质质量分数为26.5%的碳酸钠溶液,测得溶液pH随加入碳酸钠溶液质量的变化曲线如下图所示。

回答下列问题:
⑴A点处溶液中溶质的化学式是CaCl2和______________;
⑵计算原滤液中氯化钙的质量分数为_____________(写出计算过程,结果精确到0.1%)。
⑶根据计算所得数据在下图中画出产生沉淀的曲线。
 _______________
_______________
⑷CD段pH上升的原因是________________________________。
【答案】 HCl 11.1% 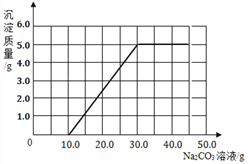 加入Na2CO3溶液增多,pH升高
加入Na2CO3溶液增多,pH升高
【解析】本题考查了根据化学反应方程式的计算和有关溶质质量分数的计算。弄清反应过程是解题的关键。
(1)稀盐酸和大理石反应生成氯化钙、水和二氧化碳,溶液中还有过量的盐酸,所以A点处溶液中溶质的化学式是CaCl2和HCl;
(2)从图中看出Na2CO3会先与盐酸反应,所以溶液的pH逐渐变大,再与CaCl2反应,BC段是CaCl2与Na2CO3反应;与CaCl2反应的Na2CO3溶液的质量为(30g-10g)=20g ;
设:滤液中CaCl2的质量为x,生成碳酸钙的质量为y。
CaCl2+Na2CO3═CaCO3↓+2NaCl,
111 106 100
x 20g×10.6% y
![]() x=5.55g,
x=5.55g,
滤液中CaCl2的质量分数=![]() ×100%=11.1%,
×100%=11.1%,
答:滤液中CaCl2的质量分数为11.1%。
(3)![]() y=5g;根据计算所得数据在下图中画出产生沉淀的曲线如图所示:
y=5g;根据计算所得数据在下图中画出产生沉淀的曲线如图所示:
(4)图中CD段表示的意义是反应结束,碳酸钠溶液过量,碳酸钠溶液呈碱性,溶液的碱性增强,CD段pH上升的原因是加入Na2CO3溶液增多,pH升高。

【题目】如图所示,在a烧杯中盛有酚酞溶液,在b烧杯中盛有浓氨水,有关现象和解释正确的是

选项 | 现象 | 解释 |
A | a烧杯溶液变红色 | b中氨气分子运动到a中,氨气溶于水,氨水呈碱性 |
B | a烧杯溶液变红色 | 氨气与酚酞反应生成红色物质 |
C | b烧杯溶液变红色 | b中氨气分子没有运动 |
D | b烧杯溶液变红色 | a中酚酞分子运动到b中,氨水呈中性 |
A. A B. B C. C D. D