题目内容
某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.

请计算:
(1)固体样品中氧化铁的质量是 克.
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
【答案】
(1)8 (2)22.9%
【解析】
试题分析:(1)设氧化铁的质量为x,则
3CO+Fe2O3 2Fe+3CO2
固体减重
2Fe+3CO2
固体减重
160 112 160﹣112=48
x (13.6g﹣11.2 g)
 =
=
解得x=8g
(2)设生成的FeCl2和H2质量分别为x、y,则
Fe+2HCl=FeCl2+H2↑
56 127 2
11.2g x y
 =
= =
=
解得x=25.4g;y=0.4g
 ×100%=22.9%.
×100%=22.9%.
答:(1)8;(2)所得溶液中溶质的质量分数为22.9%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题考查关于化学反应式的计算,需要同学们能够准确的书写化学反应式,理清物质间的关系,才可做出准确的计算.

练习册系列答案
相关题目
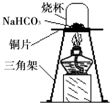 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.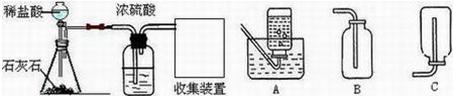
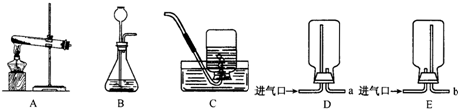
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.