题目内容
将氯化钙和氯化钠的混合物30g加入227g水里,完全溶解后,再加入53g20%的碳酸钠溶液,恰好完全反应.
试求:
(1)原混合物中含氯化钙多少克?
(2)反应后所得溶液溶质的质量分数为多少?
解:设原混合物中含氯化钙的质量为x,反应后生成碳酸钙质量为y,氯化钠质量为z
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x 53g×20% y z
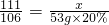 x=11.1g
x=11.1g
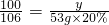 y=10g
y=10g
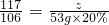 z=11.7g
z=11.7g
反应后所得溶液中溶质质量为30g-11.1g+11.7g=30.6g
反应后所得溶液的质量为30g+227g+53g-10g=300g
所得溶液溶质质量分数为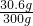 ×100%=10.2%
×100%=10.2%
答:原混合物中氯化钙的质量为11.1g;反应后所得溶液溶质的质量分数是10.2%.
分析:(1)根据题意碳酸钠和氯化钙恰好完全反应,所以可根据化学方程式求出参加反应的氯化钙的质量.
(2)所得溶液的溶质为反应前加入的氯化钠的质量和生成的氯化钠的质量之和.反应后溶液的总质量可利用质量守恒定律进行分析.
点评:本题主要考查学生对恰好完全反应的认识,以及根据化学方程式进行正确计算的能力,学生必须有牢固的知识,再加上认真细心的态度,方可完成.
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x 53g×20% y z
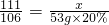 x=11.1g
x=11.1g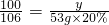 y=10g
y=10g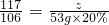 z=11.7g
z=11.7g反应后所得溶液中溶质质量为30g-11.1g+11.7g=30.6g
反应后所得溶液的质量为30g+227g+53g-10g=300g
所得溶液溶质质量分数为
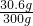 ×100%=10.2%
×100%=10.2%答:原混合物中氯化钙的质量为11.1g;反应后所得溶液溶质的质量分数是10.2%.
分析:(1)根据题意碳酸钠和氯化钙恰好完全反应,所以可根据化学方程式求出参加反应的氯化钙的质量.
(2)所得溶液的溶质为反应前加入的氯化钠的质量和生成的氯化钠的质量之和.反应后溶液的总质量可利用质量守恒定律进行分析.
点评:本题主要考查学生对恰好完全反应的认识,以及根据化学方程式进行正确计算的能力,学生必须有牢固的知识,再加上认真细心的态度,方可完成.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目