题目内容
【题目】某学校化学兴趣小组的同学为测定某石灰石样品(其中杂质不溶于水且不与稀盐酸反应)中碳酸钙的质量分数,称取12g样品做了下述实验,请根据下图所示的实验过程和提供的数据,计算:

(1)该石灰石样品中碳酸钙的质量分数。
(2)反应后所得溶液的质量分数。
【答案】⑴83.3% ;⑵10.5%
【解析】由题中信息知,生成二氧化碳气体的质量是4.4g。
由质量守恒定律知参加反应的稀盐酸质量是295.6g+4.4g-200g=100g。
解∶设该石灰石样品中碳酸钙的质量分数为x,生成氯化钙质量为y
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑
100 71 44
12g×x y 4.4g
![]() =
=![]() ,x=83.3%。
,x=83.3%。 ![]()
![]() =
=![]() ,y=7.1g。
,y=7.1g。
(2)反应后所得溶液的质量分数∶![]() ×100%=10.5%。
×100%=10.5%。
答∶(1)该石灰石样品中碳酸钙的质量分数是83.3%;(2)反应后所得溶液的质量分数是10.5%。
点睛∶灵活应用质量守恒定律,正确书写化学方程式是顺利完成本题的重要保证。

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
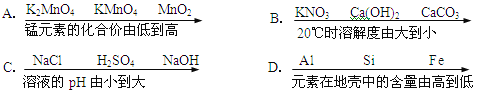
【题目】下列实验中,对应的现象以及结论都正确且两者相符的是( )
选 项 | A | B | C | D |
实 验 |
|
|
|
|
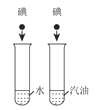
实 验 现 象 | 打开汽水瓶盖时,汽水 会自动喷出来 | 碘溶于水,几乎不溶于 汽油 | 白磷燃烧,产生大量白 烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近 | 空气中,带火星的木条 复燃;呼出气体中,带 火星的木条熄灭 |
实 验 结 论 | 说明气体在水中的溶 解度随压强的增大而 减小 | 说明物质的溶解性与 溶剂的种类有关 | 氧气约占空气体积的 五分之一 | 空气中的氧气比呼出 气体中氧气多 |
A. A B. B C. C D. D