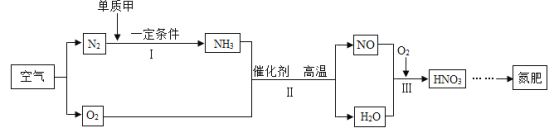
题目内容
【题目】A-F是初中化学常见的物质。A与B的组成元素相同,D、E在通常状况下是气体,F是大理石的主要成分,其转化关系如图所示,部分反应物,生成物和反应条件未标出。
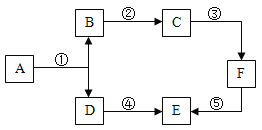
(1)组成A物质的元素是____(写元素符号)。
(2)若B与氧化钙反应生成C,则C是____(填化学式)
(3)反应①的基本反应类型是____;反应④属于____(填“吸热”或“放热”)反应。
(4)反应⑤的化学方程式是____。
【答案】H、O Ca(OH)2 分解反应 放热 ![]() 或
或![]()
【解析】
根据题干提供的信息进行分析解答,A与B的组成元素相同,A能生成B,D在通常状况下是气体,故A是过氧化氢,B是水,D是氧气,F是大理石的主要成分,故F是碳酸钙,F能够生成E,E在通常状况下是气体,E是二氧化碳,据此解答。
(1)A是过氧化氢,过氧化氢是由H、O元素组成;
(2)B是水, B与氧化钙反应生成C,即水与氧化钙反应生成氢氧化钙,C是氢氧化钙,化学式为Ca(OH)2;
(3)反应①是过氧化氢分解生成水和氧气,故反应①的基本反应类型是分解反应;D是氧气,E是二氧化碳,反应④可以是氧气和碳反应生成二氧化碳,属于放热反应;
(4)反应⑤是碳酸钙转化为二氧化碳,有关反应可以是碳酸钙和盐酸反应生成二氧化碳,或是碳酸钙在高温条件下分解生成二氧化碳,有关反应的化学方程式为![]() 或
或![]() 。
。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】欲测定铜镁合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
剩余固体质量/g | 17.6 | 15.2 | m | 14 |

(1) m的值是_____,合金中铜、镁的质量最简比是_____。
(2)计算所加稀硫酸的溶质的质量分数_____;( 写出计算过程)
(3)在如图画出加入稀硫酸与产生气体关系的曲线图_____。
【题目】在一定条件下,在一个封闭的容器内发生某反应,测得反应前后各物质的质量如表
物质 | W | O2 | H2O | CO2 |
反应前质量/g | 8 | 20 | 1 | O |
反应后质量/g | 0 | 8 | 10 | a |
下列判断正确的是
A.表中a的值为18
B.W一定含有碳、氢、氧三种元素
C.该反应属于分解反应
D.W和氧气在反应中的质量比为2:5