题目内容
【题目】晓楠发现了许多有趣的化学问题,请你帮助她解释或解决这些问题.
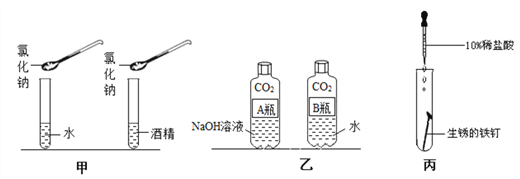
(1)①天然降水中会溶解部分空气里的二氧化碳气体。因此正常雨水的pH___7(选填“>”或“=”或“<”)。
②发生火灾时,消防员利用高压水枪灭火的主要原理是________。
③电解水实验可以得出水的组成,该反应的化学方程式为___________。
(2)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______g;配制的主要步骤有:计算、________、混匀、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、____________(两种)和试剂瓶。
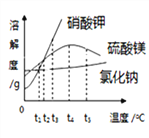
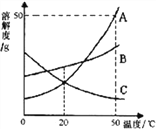
(3)①甲、乙两物质的溶解度曲线如下图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃________t℃(填“>”、“<”或“=”)。

②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是_________(填字母序号)。
A.加10g水 B.加入少量甲物质 C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
(4)酒精是可再生能源,酒精完全燃烧的化学方程式为______________。
(5)将一定量铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,下列说法正确的是_______________。
A.滤出的固体中一定含有银和铜 B.向滤出的固体中加稀盐酸一定有气泡产生
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
【答案】 < 降低温度至着火点以下 2H2O![]() 2H2↑+O2↑ 450 量取 量筒、玻璃棒 < C C2H5OH+3O2
2H2↑+O2↑ 450 量取 量筒、玻璃棒 < C C2H5OH+3O2![]() 2CO2+3H2O AD
2CO2+3H2O AD
【解析】本题主要考查了水的性质,溶液的配制,溶解度曲线的应用和金属活动性顺序的应用。
(1)①天然降水中会溶解部分空气里的二氧化碳气体,二氧化碳与水反应生成碳酸,碳酸呈酸性。因此正常雨水的pH<7;
②水在蒸发时吸热,可使可燃物的温度下降。发生火灾时,消防员利用高压水枪灭火的主要原理是降低温度至着火点以下;
③电解水实验时水分解生成了氢气和氧气,该反应的化学方程式为2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(2) 将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为:300g×25%÷10%-300g=450g;配制的主要步骤有:计算、量取、混匀、装瓶并贴上标签;实验中用到的玻璃仪器是胶头滴管、烧杯、量筒、玻璃棒和试剂瓶;
(3)①A中固体没有完全溶解,B中固体完全溶解,说明乙的溶解度比甲的溶解度大,由溶解度曲线可知,温度小于t℃时乙的溶解度大于甲,因此20℃<t℃;
②A、加少量水时,固体继续溶解,如果没有完全溶解或恰好完全溶解,溶质质量分数不变;B、加入少量甲时,不能继续溶解,溶质质量分数不变;C、升温到40℃时,由于甲的溶解度随着温度升高而增大,因此固体继续溶解,溶质质量分数增大;D、蒸发部分溶剂,恢复到20℃时,仍然是饱和溶液,溶质质量分数不变;故选C;
(4)酒精完全燃烧时生成了水和二氧化碳,化学方程式为C2H5OH+3O2![]() 2CO2+3H2O;
2CO2+3H2O;
(5)由金属活动性顺序的应用及题意可知,充分反应后溶液为无色,此现象可说明铜没有被消耗,因为镁活动性大于铜,可知硝酸银只与镁发生反应,镁可能刚好完全反应,也可能镁过量,则滤出的固体中一定含银、铜,可能含有镁,而滤液中一定含硝酸镁,一定没有硝酸铜、硝酸银。综合以上分析可知:
A、滤出的固体中一定含有银和铜,正确;B、向滤出的固体中加稀盐酸一定没有气泡产生,错误;C、滤液中一定含有硝酸镁,一定没有硝酸铜和硝酸银,错误D、滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜,正确。故选AD。

 阅读快车系列答案
阅读快车系列答案