题目内容
【题目】根据下列三个实验,回答问题:
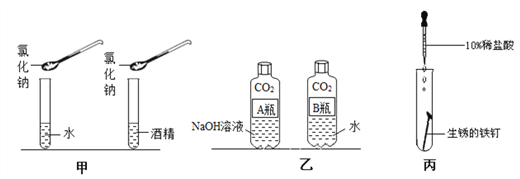
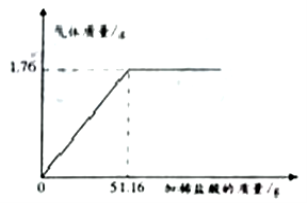
(1)实验甲是探究 NaCl 在不同溶剂中的溶解性,应该保持相同的物理量是________ (填字母序号)。
A.温度 B.NaCl 的质量 C.水和酒精的质量
(2)实验乙:将等体积的氢氧化钠溶液、水分别倒入集满二氧化碳的质地较软的塑料瓶中,拧紧瓶盖,充分振荡,观察到__________ ,证明_________ 。 写出该实验中发生反应的化学方程式_________________________ (任写一个)。
(3)实验丙:刚开始滴加稀盐酸时的实验现象是_____________________ ,写出发生反应的化学方程式___________________ 。继续滴加稀盐 酸浸没钉子,过一段时间,又会发现有_________________________ 产生, 写出发生反应的化学方程 式________________ 。实验能体现出稀盐酸具有的化学性质是______________________、_______________________ 。
【答案】 ABC A 瓶比 B 瓶更瘪 NaOH 能与CO2反应 CO2+H2O=H2CO3和2NaOH+CO2=Na2CO3+H2O 铁锈逐渐消失,溶液变成黄色 Fe2O3+6HCl=2FeCl3+3H2O 气泡 Fe+2HCl=FeCl2+H2↑ 能与金属氧化物(Fe2O3)反应 能与活泼金属(Fe)反应
【解析】本题考查了探究影响物质溶解性的因素,碱的性质,盐酸的性质。
(1)实验甲是探究NaCl在不同溶剂中的溶解性,应该保持相同的物理量是温度,NaCl的质量,水和酒精的质量,故选ABC;
(3)实验乙是探究CO2能否与氢氧化钠反应。二氧化碳能与氢氧化钠反应生成碳酸钠和水,二氧化碳能与水反应生成碳酸,瓶内的气压降低。将等体积的氢氧化钠溶液、水分别倒入集满二氧化碳的质地较软的塑料瓶中,拧紧瓶盖,充分振荡,观察到A瓶变瘪的程度大于B瓶,证明CO2能与NaOH发生反应,反应的化学方程式是2NaOH+CO2=Na2CO3+H2O和 CO2+H2O=H2CO3;
(3)实验丙:生锈的铁钉外面覆盖一层铁锈刚开始滴加稀盐酸时氧化铁与盐酸反应生成氯化铁和水。实验现象是铁锈逐渐消失,溶液变成黄色,反应的化学方程式是Fe2O3+6HCl=2FeCl3+3H2O。铁锈反应后,盐酸会与铁接触反应生成氯化亚铁和氢气,继续滴加稀盐 酸浸没钉子,过一段时间,又会发现有气泡产生,反应的化学方程式Fe+2HCl=FeCl2+H2↑;氧化铁是氧化物,铁是金属、实验能体现出稀盐酸具有的化学性质是能与金属氧化物(Fe2O3)反应、能与活泼金属(Fe)反应。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案