题目内容
【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验: 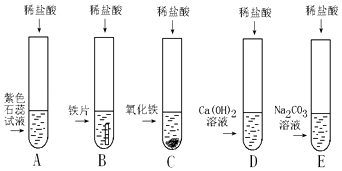
(1)试管A中的现象是 , 反应后试管B中一定有的阳离子是(写离子符号).
(2)试管C中反应的化学方程式为 . 小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成.过滤,得到白色沉淀和无色滤液.
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 .
(3)【提出问题】无色滤液的溶质是什么? 【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl、CaCl2和Na2CO3;④NaCl和Na2CO3 .
小明认为猜想一定不正确.
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |
【答案】
(1)溶液变为红色;Fe2+
(2)Fe2O3+6HCl═2FeCl3+3H2O;混合后,先有气泡产生,后有白色沉淀生成,说明盐酸被消耗完
(3)③;④;稀盐酸
【解析】解:(1)酸能使紫色石蕊试液变红,故试管A中的现象是溶液变为红色;铁与盐酸反应,生成氯化亚铁和氢气,反应后试管B中一定有的阳离子是亚铁离子,符号为:Fe2+;(2)氧化铁与盐酸反应生成氯化铁和水,试管C中反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.由实验的现象可知,混合后的溶液先产生气泡,说明在E中有剩余的碳酸钠,另一支试管D中有剩余的盐酸,后有白色沉淀生成,沉淀应为碳酸钙,说明溶液含有氯化钙.故小芳同学分析得出无色滤液中一定不含HCl,理由是混合后,先有气泡产生,后有白色沉淀生成,说明盐酸被消耗完;【作出猜想】由上述分析可知,当碳酸钠与盐酸、氯化钙恰好反应时,滤液中只含有氯化钠;当氯化钙有剩余时,滤液中含有氯化钠和氯化钙,当碳酸钠剩余时,滤液中含有氯化钠和碳酸钠. 小明认为猜想③一定不正确.因为氯化钙和碳酸钠反应,不能同时存在;
【进行实验】由于碳酸钠能与酸盐反应生成二氧化碳气体,所以,设计实验如下:
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 ④成立 |
②取少量滤液于试管中,滴加少量 稀盐酸 | 有气泡产生 |
所以答案是:(1)溶液变为红色;Fe2+;(2)Fe2O3+6HCl═2FeCl3+3H2O.
混合后,先有气泡产生,后有白色沉淀生成,说明盐酸被消耗完;
【作出猜想】③;
验现象 | 实验结论 | |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 ④成立 |
②取少量滤液于试管中,滴加少量 稀盐酸 | 有气泡产生 |
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案