题目内容
【题目】生物浸出技术在金属冶炼中应用广泛。利用该技术以黄铜矿(主要成分CuFeS2)为原料,制取补血剂原料碳酸亚铁并回收铜,主要流程如下图所示:
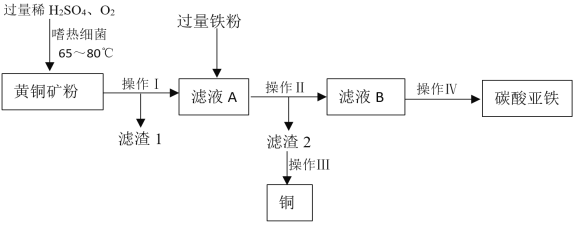
该流程发生的部分化学反应如下:
反应一:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O;
4CuSO4+2Fe2(SO4)3+2H2O;
反应二:Fe+Fe2(SO4)3=3FeSO4
(1)反应二所属的反应基本类型是_____。
(2)操作III包括:①过滤,②洗涤,③加足量稀硫酸,④干燥。正确操作顺序是_____(填序号),步骤③加足量稀硫酸的作用是_____。
(3)滤液A含有的阳离子是_____(填离子符号)。
(4)操作Ⅳ需加入一种试剂实现其转化,该试剂必须满足的条件是_____。
【答案】化合反应 ③①②④ 除去多余的铁 Cu2+、Fe 3+和H+ 可溶性碳酸盐
【解析】
(1)反应二的化学方程式为:Fe+Fe2(SO4)3=3FeSO4,符合“多变一”的特征,是化合反应;
(2)正确的操作顺序是加足量稀硫酸、过滤、洗涤、干燥;所以正确的顺序是:③①②④;铁和稀硫酸反应,铜核外稀硫酸不反应,步骤③加足量稀硫酸的作用是:除去多余的铁;
(3)由化学方程式4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O可知:滤液 A 含有的阳离子是:Cu2+、Fe 3+;因为加入的是过量的稀硫酸,滤液A中还有H+;
4CuSO4+2Fe2(SO4)3+2H2O可知:滤液 A 含有的阳离子是:Cu2+、Fe 3+;因为加入的是过量的稀硫酸,滤液A中还有H+;
(4)根据质量守恒定律,反应后生成不溶性碳酸亚铁,操作Ⅱ是硫酸亚铁生成碳酸亚铁,所以需要加入中需加入可溶性碳酸盐如碳酸钠溶液等,从而生成难溶性的碳酸亚铁。

【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
Ⅰ.定性探究
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入适量的二氧化碳 | 产生_____, 红色消失 | 氢氧化钡溶液能与 二氧化碳反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量 的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与 碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式_____;
同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀_____(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠, ②氢氧化钠、碳酸钠, ③_____。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中, 加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中, 加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:_____。
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是_____。
Ⅱ.定量探究
向100g氢氧化钡溶液中滴加溶质质量分数为10%的硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。
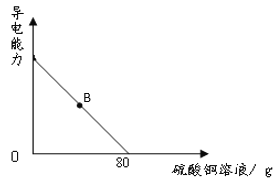
(1)溶液处于B点时,其中含有的是_____、_____、_____(填微粒符号)。
(2)计算氢氧化钡溶液的溶质质量分数_____。