题目内容
【题目】铁生锈及防护
①铁锈主要成分为__________,结构__________,易__________水→生锈后应__________去锈。
②铁生锈的实质:铁与__________、__________发生缓慢氧化。
③探究铁生锈:

①____;②____。
④防止生锈的措施
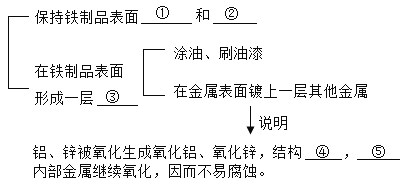
①____;②____;③____;④____;⑤____。
【答案】氧化铁或Fe2O3 疏松多孔 吸附 及时 水 氧气 一部分浸没在水中 植物油 干燥 洁净 保护层 致密 阻止
【解析】
①铁锈的主要成分是氧化铁,其化学式为Fe2O3,故填氧化铁或Fe2O3;
铁锈的结构特点是疏松多孔,故填疏松多孔;
疏松多孔的铁锈具有吸附性,能够吸附空气中的水分和氧气与内层的铁继续接触,会加快铁制品的锈蚀,故填吸附;
铁锈会加快铁制品的锈蚀,所以铁制品生锈后应及时除锈,故填及时。
②铁的锈蚀主要是铁与空气中的水和氧气发生缓慢氧化的结构,故填水和氧气。
③探究铁生锈:①探究铁在有水有气的条件下是否锈蚀,可以将铁的一部分浸没在水中,故填一部分浸没在水中;
②为实现有水无气的条件,可以将植物油覆盖在水面上,防止氧气溶于水,故填植物油。
④防止生锈的措施:①防止铁制品生锈,应保持铁制品表面干燥,不与水接触,故填干燥;
②处保持铁制品避免干燥外,还要保持铁制品表面洁净,不能在铁制品表面附着酸或盐等物质,防止会加快铁制品的锈蚀,故填洁净;
③避免铁制品锈蚀,还可以在铁制品表面涂覆保护层,隔绝铁制品与空气中的水分和氧气接触,故填保护层;
④在铁制品表面镀锌或铝后,锌或铝能与空气中的氧气反应生成致密的氧化锌或氧化铝薄膜,故填致密;
⑤致密的氧化锌或氧化铝薄膜能够隔绝铁制品与空气中的水分和氧气的接触,能够阻止内部金属继续氧化,故填阻止。

【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。
时间 | 质量/g | |||||
水 | 饱和石灰水 | 稀盐酸 | 浓硫酸 | 氢氧化钠浓溶液 | 氯化钙溶液 | |
1天 | 8.16 | 8.37 | 8.64 | 11.18 | 9.38 | 10.25 |
2天 | 5.76 | 5.94 | 6.69 | 12.55 | 8.47 | 10.33 |
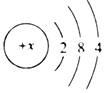
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。图中表示氧原子,表示氢原子)

(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体,则该溶液是________(填“饱和”或“不饱和”)溶液。(已知该温度下氯化钠溶解度为36.1g)
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(注意:若答对第(6)小题奖励4分,化学试卷总分不超过60分。)
(3)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,由此能否计算所得溶液中溶质组成?若能,请计算其组成;若不能,请补充完成实验方案设计,同时说明需要测定的数据(用a表示),并计算a的取值范围___________。(不要求写出计算过程)
【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
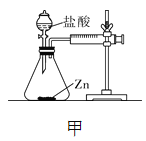
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
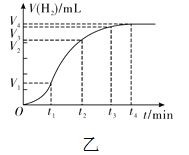
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。