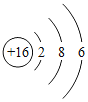题目内容
【题目】为测定某H2SO4溶液的溶质质量分数,现取200g硫酸溶液置于烧杯中,不断加入一定质量分数的BaCl2溶液,反应过程中杯中溶液的质量与加入BaCl2溶液的质量关系如图所示。请回答:

(1)反应生成沉淀的质量为_____g;在Q点时溶液中的离子为_____(用符号)。
(2)在反应过程中,杯中溶液的pH_____(填“变大”、“不变”或“变小”)。
(3)原硫酸溶液的溶质质量分数是多少_____?
【答案】23.3 H+、Cl﹣、Ba2+ 变大 4.9%
【解析】
(1)由图中信息可知,P点时氯化钡和硫酸恰好完全反应,反应前后的质量差即为反应生成沉淀硫酸钡的质量,则生成的硫酸钡的质量是200g+100g﹣276.7g=23.3g,故填23.3;
Q点的氯化钡溶液过量,溶液中的溶质为盐酸和氯化钡,在Q点时溶液中的离子为H+、Cl﹣、Ba2+,故填H+、Cl﹣、Ba2+;
(2)反应的过程中硫酸不断被消耗,生成盐酸,随氯化钡溶液的加入,溶剂增加,溶液的酸性不断变弱,所以pH会不断变大,故填变大;
(3)设氯化钡质量为x。
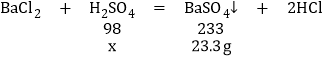
![]()
x=9.8g
原硫酸溶液的溶质质量分数为:![]() ×100%=4.9%
×100%=4.9%
答:硫酸溶液的溶质质量分数为4.9%。

【题目】人类的生产生活离不开金属材料.
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属__的位置移到最后,正好符合由弱到强的__顺序.
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中,利用金属导热性的是__,延展性的是__(填字母序号).

(3)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和__共同作用的结果.
(4)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点低于任何一种组成金属的熔点.下表是一些金属的熔点数据.
金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
①铅锡合金中某种金属的质量分数与合金的熔点有如图2所示的关系,其中横坐标表示的是__的质量分数;当合金熔点最低时,合金中铅与锡的质量比为__.
②保险丝由铋、铅、锡、镉组成,其熔点约为__.
A.15~30℃; B.60~80℃; C.235~250℃; D.300~320℃.