题目内容
【题目】芯片的基材主要是高纯硅。如图是一种制备高纯硅的工艺流程图:
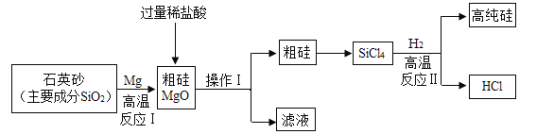
[查阅资料]常温下,氯化镁溶液呈中性
(1)操作I的名称是_________,该操作使用到的玻璃仪器有:玻璃棒、烧杯和___________。
(2)反应I的化学方程式:2X+SiO2![]() Si+2MgO,其中X为:___________(填化学式);SiO2中Si元素的化合价为___________;
Si+2MgO,其中X为:___________(填化学式);SiO2中Si元素的化合价为___________;
(3)写出反应II的化学方程式____________该反应属于_______________(填基本反应类型);该反应要在无氧的环境中进行,原因是_______(答出一种即可)
(4)上述已知生产流程中,可以循环利用的物质是____________(填化学式)。
(5)简要叙述检验盐酸已过量的方法_________________。
【答案】过滤 漏斗 Mg +4 SiCl4+2H2![]() Si+4HCl 置换反应 防止爆炸(或防止生成的硅被氧化) HCl 取滤液少量于试管中,加入金属镁,有气泡产生。(合理即可)
Si+4HCl 置换反应 防止爆炸(或防止生成的硅被氧化) HCl 取滤液少量于试管中,加入金属镁,有气泡产生。(合理即可)
【解析】
(1)操作1是将固液分离,故是过滤。过滤操作中用到玻璃棒、烧杯和漏斗。
(2)反应2X+SiO2![]() Si+2MgO中,反应物中硅、镁、氧的原子个数分别是1、0、2,生成物中硅、镁、氧的原子个数分别是1、2、2,故2X中含有2个镁原子,故X是金属镁,化学式为Mg。
Si+2MgO中,反应物中硅、镁、氧的原子个数分别是1、0、2,生成物中硅、镁、氧的原子个数分别是1、2、2,故2X中含有2个镁原子,故X是金属镁,化学式为Mg。
(3)SiCl4和氢气在高温的条件下反应生成硅和氯化氢,反应的方程式为:. SiCl4+2H2![]() Si+4HCl。该反应符合置换反应的特点,故是置换反应。氢气是易燃气体,和氧气混合加热会发生爆炸,为了防止爆炸,要在无氧的环境下进行。
Si+4HCl。该反应符合置换反应的特点,故是置换反应。氢气是易燃气体,和氧气混合加热会发生爆炸,为了防止爆炸,要在无氧的环境下进行。
(4)反应的开始和结束都有HCl,故循环利用的物质是HCl。
(5)酸可以与金属反应生成气体,故检验方法是:取滤液少量于试管中,加入金属镁,有气泡产生,说明盐酸已经过量。(合理即可)