题目内容
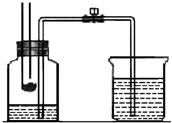 某校化学学习小组在学习了“空气中氧气含量测
某校化学学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出了如图
所示的实验装置.实验步骤如下:
①如图所示,连接仪器,检查装置的气密性.
②在集气瓶里装进适量a毫升的水,集气瓶剩余体积为V毫升,燃烧匙里放足量白磷,并在酒精灯上把玻璃棒下端加热,按图示装置把集气瓶中的空气密封起来,把长导管的另一端放入盛有足量水的烧杯中.(注:集气瓶内的长导管已伸到了瓶底.)
③把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,产生大量白烟,同时放出大量的热.
④待白磷燃烧熄灭后,稍加振荡,白烟消失.
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积.
根据以上信息,回答下列问题:
(1)白磷燃烧的化学方程式
在白磷开始燃烧到最后熄灭冷却的过程中,集气瓶内水面的变化情况是
若实验非常成功,最终集气瓶中水的体积约为
(2)组内成员小张对“实验前集气瓶里要装进适量a体积的水”非常不理解.咨询了组长小明之后,他终于明白“a体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二主要是
(3)组内成员小杭无意间发现向⑤步骤集气瓶内的水中滴加几滴紫色石蕊试液,会变红.这一现象使组内成员积极地展开了讨论,成员小葛认为是由于二氧化碳溶于水,使溶液显酸性而导致的,但小明马上作出反对,原因是空气中二氧化碳的含量极少,而实验过程中又没有产生二氧化碳,短时间内不可能会使溶液显酸性.你认为谁的观点正确?
分析:(1)白磷与氧气反应生成五氧化二磷;利用白磷和氧气反应放热、氧气的量约占空气体积的五分之一解决问题;
(2)围绕“降温以及吸收燃烧产物”这一因素进行分析;
(3)从使石蕊试液变红色的溶液显酸性的知识进行猜想.
(2)围绕“降温以及吸收燃烧产物”这一因素进行分析;
(3)从使石蕊试液变红色的溶液显酸性的知识进行猜想.
解答:解:(1)①白磷立即着火燃烧,产生大量白烟,生成五氧化二磷,化学方程式为4P+5O2
2P2O5;
②白磷燃烧放出大量的热,使集气瓶中压强增加,大于大气压强,液面下降,空气中的氧气被消耗,熄灭冷却后,集气瓶中的压强小于大气压强,液面上升,所以集气瓶中水面先下降后上升;
③由于氧气约占空气体积的五分之一,进入的水也是这一比例,则最终集气瓶中水的体积为:a+
v;
(2)由于温度的改变会影响水的进入,所以需要使集气瓶温度尽快降低至室温,同时水也对吸收产物有一定作用.
“a体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二主要是吸收白磷燃烧生成的五氧化二磷; (3)小明的观点正确,白磷燃烧生成的五氧化二磷溶于水显酸性,滴加几滴紫色石蕊试液,会变红.
故答案为:
(1)4P+5O2
2P2O5,先下降后上升,a+
v;
(2)吸收白磷燃烧生成的五氧化二磷
(3)小明,可能是白磷燃烧生成的五氧化二磷溶于水(或与水反应),导致溶液显酸性.
| ||
②白磷燃烧放出大量的热,使集气瓶中压强增加,大于大气压强,液面下降,空气中的氧气被消耗,熄灭冷却后,集气瓶中的压强小于大气压强,液面上升,所以集气瓶中水面先下降后上升;
③由于氧气约占空气体积的五分之一,进入的水也是这一比例,则最终集气瓶中水的体积为:a+
| 1 |
| 5 |
(2)由于温度的改变会影响水的进入,所以需要使集气瓶温度尽快降低至室温,同时水也对吸收产物有一定作用.
“a体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二主要是吸收白磷燃烧生成的五氧化二磷; (3)小明的观点正确,白磷燃烧生成的五氧化二磷溶于水显酸性,滴加几滴紫色石蕊试液,会变红.
故答案为:
(1)4P+5O2
| ||
| 1 |
| 5 |
(2)吸收白磷燃烧生成的五氧化二磷
(3)小明,可能是白磷燃烧生成的五氧化二磷溶于水(或与水反应),导致溶液显酸性.
点评:空气中氧气含量的测定也是中考考查的一个热点,重点考查实验过程中看到的现象以及导致实验结果偏大或偏小的原因.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.