题目内容
【题目】黄铜矿(主要成分是CuFeS2)经初步处理后。所得溶液甲中的溶质为Fe2(SO4)3、CuSO4和H2SO4。某同学利用废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜的主要流程如图所示[已知![]() ]
]
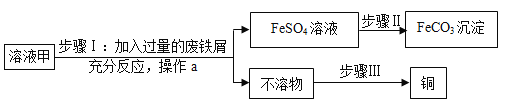
(1)溶液甲呈酸性,请写出测定溶液甲酸碱度的方法_________________________。
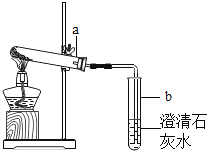
(2)操作a的名称是__________________,步骤Ⅰ加入的废铁屑中含有少量铁锈,但对产物的成分没有影响,原因是________________________。
(3)写出步骤Ⅱ发生反应的化学方程式________________________。
(4)写出黄铜矿的一种用途________________________。
【答案】在白瓷板或玻璃片上放上pH试纸,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把显示的颜色与标准比色卡对比,读出pH即可 过滤 铁锈中的氧化铁能与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁 ![]() 冶炼铜(答案合理即可)
冶炼铜(答案合理即可)
【解析】
(1)用pH试纸测定某溶液的pH时,正确的操作方法为在白瓷板或玻璃片上放上pH试纸,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把显示的颜色与标准比色卡对比,读出pH即可.故答案为:在白瓷板或玻璃片上放上pH试纸,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把显示的颜色与标准比色卡对比,读出pH即可;
(2)由流程图可知,操作a是将固体与液体分离,名称是过滤;步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;故答案为:过滤;铁锈中的氧化铁能与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(3)步骤Ⅱ是由硫酸亚铁转化为碳酸亚铁沉淀,可能是硫酸亚铁和碳酸钠反应生成碳酸亚铁和硫酸钠,反应的方程式为:![]() ;故填:
;故填:![]() ;
;
(4)由工艺流程图可知,黄铜矿经过一系列变化最终得到了补血剂原料碳酸亚铁并回收铜,故填:冶炼铜(答案合理即可).

【题目】科学研究中常将不易观察、微观的现象或不易直接测量的通过实验的方法转换为易观察、宏观的现象或易测量的,此方法叫转换法。下列实验中,没有运用转换法的是( )
|
|
|
|
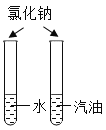
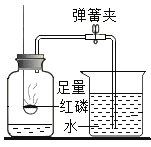
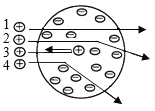
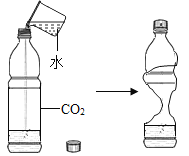
A.探究同种溶质在不同溶剂中的溶解性 | B.探究空气中氧气含量 | C.用a粒子轰击原子研究原子结构 | D.探究CO2的性质 |
A.AB.BC.CD.D