题目内容
(2005?南通)某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:①取8.5g Fe粉放入一定量的CuSO4中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2g.
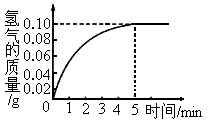
②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0g,根据实验绘制反应产生氢气的质量与反应时间的关系见图.求:
(1)稀盐酸的质量分数、与稀盐酸反应的Fe的质量.
(2)与CuSO4反应的Fe的质量.
(3)与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和______8.5g(选填“>”、“<”或“=”).对此结果作出你的解释______.
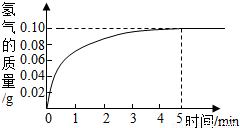
【答案】分析:(1)因为铜不与盐酸反应,故产生氢气的反应是Fe与盐酸反应.利用Fe与盐酸反应的化学方程式和生成氢气的质量(由图示数据可知,完全反应后生成氢气的质量为0.10g),列出比例式,就可计算出与稀盐酸反应的Fe的质量和盐酸的质量,然后根据溶质质量分数公式就可计算出稀盐酸的质量分数;
(2)分析题意可知,9.2g固体减去与稀盐酸反应的Fe的质量就是置换出的铜的质量.利用Fe与硫酸铜反应的化学方程式,列出比例式,就可计算出与CuSO4反应的Fe的质量;
(3)计算出“与稀盐酸反应的Fe的质量+与CuSO4反应的Fe的质量”之和,与8.5g比较;根据已知条件和计算出的数据进行分析.
解答:解:(l)设与稀盐酸反应的Fe的质量为x,盐酸的质量为w.
Fe+2HCl═FeCl2+H2↑
56 73 2
x w 0.10g
∴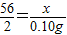 ,
,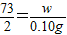 ,
,
解之得:x=2.8g;w=3.65g;
稀盐酸的质量分数为: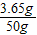 ×100%=7.3%;
×100%=7.3%;
答:稀盐酸的质量分数为7.3%;与稀盐酸反应的Fe的质量为2.8g;
(2)设与CuSO4反应的Fe的质量为y,
Fe+CuSO4═FeSO4+Cu
56 64
y 9.2g一2.8g
∴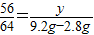 ,
,
解之得:y=5.6g;
答:与CuSO4反应的Fe的质量为5.6g;
(3)与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和为:2.8g+5.6g=8.4g<8.5g;
在Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生,而且与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和<8.5g,说明有少量Fe与CuSO4溶液中的酸性物质发生了反应,产生了氢气.
故答案为:<;因为有少量Fe与CuSO4溶液中的酸性物质发生了反应.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.学生需根据金属的活动性的知识,分析物质间的反应情况,正确运用化学方程式进行计算.
(2)分析题意可知,9.2g固体减去与稀盐酸反应的Fe的质量就是置换出的铜的质量.利用Fe与硫酸铜反应的化学方程式,列出比例式,就可计算出与CuSO4反应的Fe的质量;
(3)计算出“与稀盐酸反应的Fe的质量+与CuSO4反应的Fe的质量”之和,与8.5g比较;根据已知条件和计算出的数据进行分析.
解答:解:(l)设与稀盐酸反应的Fe的质量为x,盐酸的质量为w.
Fe+2HCl═FeCl2+H2↑
56 73 2
x w 0.10g
∴
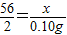 ,
,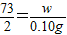 ,
,解之得:x=2.8g;w=3.65g;
稀盐酸的质量分数为:
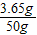 ×100%=7.3%;
×100%=7.3%;答:稀盐酸的质量分数为7.3%;与稀盐酸反应的Fe的质量为2.8g;
(2)设与CuSO4反应的Fe的质量为y,
Fe+CuSO4═FeSO4+Cu
56 64
y 9.2g一2.8g
∴
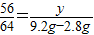 ,
,解之得:y=5.6g;
答:与CuSO4反应的Fe的质量为5.6g;
(3)与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和为:2.8g+5.6g=8.4g<8.5g;
在Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生,而且与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和<8.5g,说明有少量Fe与CuSO4溶液中的酸性物质发生了反应,产生了氢气.
故答案为:<;因为有少量Fe与CuSO4溶液中的酸性物质发生了反应.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.学生需根据金属的活动性的知识,分析物质间的反应情况,正确运用化学方程式进行计算.

练习册系列答案
相关题目

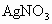 溶液时不宜使用自来水,其原因是(用化学方程式表示)________.高铁酸钾
溶液时不宜使用自来水,其原因是(用化学方程式表示)________.高铁酸钾 是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________.
是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________.
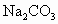 、
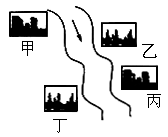
、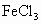 、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
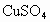 溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:
溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验: