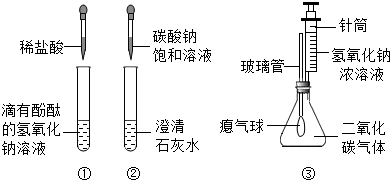
题目内容
某兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1) 在甲实验过程中,插入一支温度计来测量溶液的温度时,随着稀盐酸的不断滴入,
溶液的温度逐渐升高,你认为溶液温度升高的原因是 ;
写出该反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 ;
反应的化学方程式 。
(3)实验结束后,同学们将甲、乙两个实验的废液倒入同一个干净的废液缸中,看到有
气泡出现,最终废液呈红色,由此产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:指示剂、水和 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小兰认为:只有碳酸钠(提示:碳酸钠水溶液PH﹥7);小亮认为:只有氢氧化钠。
你认为还可能是 。
【实验设计】小斌想用氯化钙溶液来验证小兰、小亮和你的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小斌的实验设计补充完整。
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上 层清液于试管中, 加入过量氯化钙 溶液,静置。 | ①没有白色沉淀,溶液呈红色。 | 的猜想正确。 |
| ②有白色沉淀,溶液由红色变 为无色 | 的猜想正确。 | |
| ③ | 你的猜想正确。 |
由红色变为无色,试计算氢氧化钠溶液中溶质的质量分数。(提示:氢氧化钠溶液的密度为1g/ml)
(1) 中和反应(或该反应)放出热量;NaOH + HCl === NaCl + H2O ;
(2)气球胀大 ;CO2+ 2NaOH === Na2CO3 + H2O
【交流讨论】 ① 氯化钠 ;(写化学式也可)
② 氢氧化钠和碳酸钠;(写化学式也可)
【实验设计】①小亮 ;② 小兰 ③有白色沉淀,溶液呈红色。
(以上每空1分)
(4)解:设参加反应的氢氧化钠的质量为X:
NaOH + HCl === NaCl + H2O
40 36.5
X 20.0g ×7.3% ……………………(1分)
40/36.5=X/20.0g ×7.3% (或40 : 36.5=X : 20.0g ×7.3%)
X =1.6g ……………………………………… (1分)
氢氧化钠中溶质的质量分数为1.6g/10ml ×1g/ml×100%="16.0" % ………(1分)
答:稀盐酸中溶质的质量分数为16.0%
解析