题目内容
(2010?鞍山)某兴趣小组在学习碱的化学性质时,进行了如图所示的实验.
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个子净的废液缸中,最终 看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化 钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑

(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
.(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是
气球胀大
气球胀大
.(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个子净的废液缸中,最终 看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和
NaCl
NaCl
.②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是
氢氧化钠
氢氧化钠
.(写一种猜想)【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化 钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小亮 小亮 的猜想正确. |
| ② 无现象,溶液呈红色 无现象,溶液呈红色 | 小刚 小刚 的猜想正确. | |
| ③ 有白色沉淀,溶液呈无色 有白色沉淀,溶液呈无色 | 小兰 小兰 的猜想正确. |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑
反应物是否有剩余
反应物是否有剩余
.分析:(1)方程式书写方法来回答;
(2)二氧化钠与氢氧化钠反应压强减小考虑;
(4)①根据几种反应的生成物考虑;②使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠等根据碳酸根的检验方法来考虑.
(2)二氧化钠与氢氧化钠反应压强减小考虑;
(4)①根据几种反应的生成物考虑;②使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠等根据碳酸根的检验方法来考虑.
解答:解:(1)盐酸和氢氧化钠发生的是复分解反应相互交换成分,生成氯化钠和水,直接已经平了;
(2)二氧化钠与氢氧化钠反应压强减小,在外界大气压的作用下空气进入气球,气球胀大;
(4)①由于盐酸与氢氧化钠反应生成了氯化钠,而氯化钠显中性又不易和其它物质反应,所以一定含有氯化钠;
②使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠,溶液中不能剩氢氧化钙和碳酸钠,因为二者继续反应,所以只有还有可能是氢氧化钠和氢氧化钙了;
【实验设计】
【反思拓展】在分析化学反应后所得物质的成分时不仅考虑生成物有什么,还需要考虑反应物中什么物质过量问题,谁过量就含有谁.
故答案为:(1)NaOH+HCl═NaCl+H2O;
(2)气球胀大;
(4)【交流讨论】①NaCl,②氢氧化钠
【实验设计】
【反思拓展】反应物是否有剩余
(2)二氧化钠与氢氧化钠反应压强减小,在外界大气压的作用下空气进入气球,气球胀大;
(4)①由于盐酸与氢氧化钠反应生成了氯化钠,而氯化钠显中性又不易和其它物质反应,所以一定含有氯化钠;
②使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠,溶液中不能剩氢氧化钙和碳酸钠,因为二者继续反应,所以只有还有可能是氢氧化钠和氢氧化钙了;
【实验设计】
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小亮的猜想正确. |
| ②无现象,溶液呈红色. | 小刚的猜想正确. | |
| ③有白色沉淀,溶液呈无色. | 小兰的猜想正确. |
故答案为:(1)NaOH+HCl═NaCl+H2O;
(2)气球胀大;
(4)【交流讨论】①NaCl,②氢氧化钠
【实验设计】
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氢氧化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小亮的猜想正确. |
| ②无现象,溶液呈红色. | 小刚的猜想正确. | |
| ③有白色沉淀,溶液呈无色. | 小兰的猜想正确. |
点评:通过回答本题知道了碳酸根的检验方法,掌握了在分析化学反应后所得物质的成分时不仅考虑生成物有什么,还需要考虑反应物中什么物质过量问题.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
(2010?鞍山)某兴趣小组在学习碱的化学性质时,进行了如图所示的实验.
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式______.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是______.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和______.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是______.(写一种猜想)
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑______.

(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式______.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是______.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和______.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是______.(写一种猜想)
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | ______的猜想正确. |
| ②______ | ______的猜想正确. | |
| ③______ | ______的猜想正确. |
(2010?鞍山)我国钢铁产量居全球第一,占全球总产量的30%以上.某兴趣小组到钢铁厂做社会调查,取钢样(假设只含铁和碳)进行实验.他们向组成完全相同的四份钢样粉末中分别加入100g稀H2SO4溶液,充分反应后,测得的实验数据如下表所示:
请计算:稀硫酸完全反应的实验中,反应后溶液中溶质的质量分数是多少?(结果保留至0.1%)
| 实验l | 实验2 | 实验3 | 实验4 | |
| 钢样粉末质量 | 2.84g | 4.26g | 6.23g | 7.5lg |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
(2010?鞍山)某兴趣小组在学习碱的化学性质时,进行了如图所示的实验.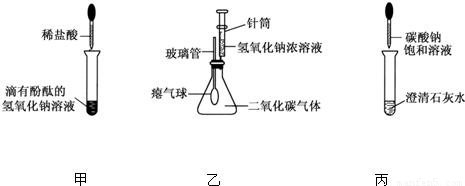
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式______.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是______.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和______.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是______.(写一种猜想)
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑______.

(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式______.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是______.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】①一定含有的物质:碳酸钙、指示剂、水和______.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是______.(写一种猜想)
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | ______的猜想正确. |
| ②______ | ______的猜想正确. | |
| ③______ | ______的猜想正确. |