题目内容
等质量的下列金属含原子数目最多的是
- A.锌
- B.铜
- C.镁
- D.银
C
分析:同质量的金属,原子数最多即原子质量最小,因为原子的原子量与其质量是成正比关系,所以原子量最小的即是原子个数最多的金属.
解答:元素的原子量与其真实质量成正比,由于原子量的大小关系是镁<铜<锌<银,所以真实质量也是这一关系,故相同质量的三种金属含原子的多少关系是:镁<铜<锌<银.
故选C
点评:此题是对原子个数的考查题,解题时用到的知识是元素的原子量与原子的真实成正比关系.
分析:同质量的金属,原子数最多即原子质量最小,因为原子的原子量与其质量是成正比关系,所以原子量最小的即是原子个数最多的金属.
解答:元素的原子量与其真实质量成正比,由于原子量的大小关系是镁<铜<锌<银,所以真实质量也是这一关系,故相同质量的三种金属含原子的多少关系是:镁<铜<锌<银.
故选C
点评:此题是对原子个数的考查题,解题时用到的知识是元素的原子量与原子的真实成正比关系.

练习册系列答案
相关题目

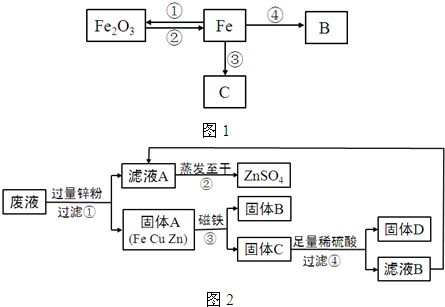
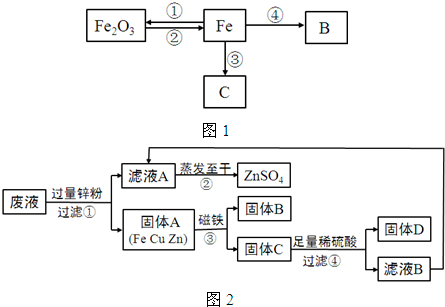
 已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3;②它主要通过热还原法冶炼而成;③它的年产量位于金属之首.
已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3;②它主要通过热还原法冶炼而成;③它的年产量位于金属之首.