题目内容
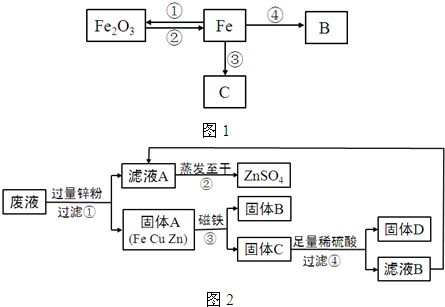
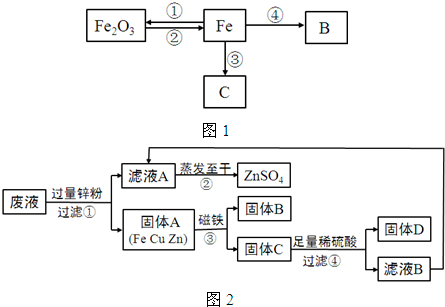
如图1所示是关于铁的化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为紫红色固体单质.请回答下列问题:
(1)B物质的一种用途是
(2)反应①导致每年有大量的铁锈蚀,为阻止铁锈蚀的发生,人们常采用在铁表面涂刷油漆或镀上其他金属等方法.铁锈蚀的原理是铁与
(3)反应③原理可用于工业“湿法冶金”,某工厂将含有CuSO4、ZnSO4、FeSO4的废液,经重新处理回收有关金属和化合物,设计了如图2工艺流程图,请据图回答:
a.步骤①中锌粉必须过量的原因是
b.步骤①中任一反应的化学方程式为
c.检验步骤④中加入的稀硫酸是否足量的方法是
d.若流程图中的物质损失可以忽略,最终所得硫酸锌的质量
(4)冶炼21t含杂质质量分数为3%的生铁,需要含氧化铁的质量分数为75%的赤铁矿石的质量是多少?

(1)B物质的一种用途是
做燃料
做燃料
.(2)反应①导致每年有大量的铁锈蚀,为阻止铁锈蚀的发生,人们常采用在铁表面涂刷油漆或镀上其他金属等方法.铁锈蚀的原理是铁与
O2
O2
和H2O
H2O
接触.(3)反应③原理可用于工业“湿法冶金”,某工厂将含有CuSO4、ZnSO4、FeSO4的废液,经重新处理回收有关金属和化合物,设计了如图2工艺流程图,请据图回答:
a.步骤①中锌粉必须过量的原因是
确保废液中的CuSO4、FeSO4完全反应
确保废液中的CuSO4、FeSO4完全反应
.b.步骤①中任一反应的化学方程式为
Zn+CuSO4=ZnSO4+Cu
Zn+CuSO4=ZnSO4+Cu
.c.检验步骤④中加入的稀硫酸是否足量的方法是
向固体D中加入稀硫酸,若有气泡产生,说明加入的稀硫酸不足量
向固体D中加入稀硫酸,若有气泡产生,说明加入的稀硫酸不足量
.d.若流程图中的物质损失可以忽略,最终所得硫酸锌的质量
>
>
(填“>”、“<”或“=”)原废液中硫酸锌的质量.(4)冶炼21t含杂质质量分数为3%的生铁,需要含氧化铁的质量分数为75%的赤铁矿石的质量是多少?
分析:(1)根据题意“密度最小的气体”为氢气,则气体B为氢气;结合转化关系图由铁而转化成“紫红色固体单质”C为铜;然后根据物质的性质和反应规律进行填空;
(2)根据铁生锈的条件考虑即可;
(3)根据废液中成分CuSO4、ZnSO4、FeSO4,可知加入过量的锌粉是把能与锌反应的物质都反应掉;根据锌与硫酸铜,或与硫酸亚铁反应的方程式考虑;步骤④中加入的稀硫酸是为了和锌反应,主要看是否有没反应的锌就行;根据硫酸新的来源考虑与原硫酸锌质量的多少即可.
(4)根据化学变化过程中元素质量不变,赤铁矿石中所含铁元素质量与冶炼出的生铁中含铁元素质量相等,由铁矿石质量可计算生铁质量;也可以由生铁的质量和含杂质的质量分数及赤铁矿中氧化铁的质量分数,根据一氧化碳与氧化铁反应的化学方程式可以计算出需要赤铁矿石的质量.
(2)根据铁生锈的条件考虑即可;
(3)根据废液中成分CuSO4、ZnSO4、FeSO4,可知加入过量的锌粉是把能与锌反应的物质都反应掉;根据锌与硫酸铜,或与硫酸亚铁反应的方程式考虑;步骤④中加入的稀硫酸是为了和锌反应,主要看是否有没反应的锌就行;根据硫酸新的来源考虑与原硫酸锌质量的多少即可.
(4)根据化学变化过程中元素质量不变,赤铁矿石中所含铁元素质量与冶炼出的生铁中含铁元素质量相等,由铁矿石质量可计算生铁质量;也可以由生铁的质量和含杂质的质量分数及赤铁矿中氧化铁的质量分数,根据一氧化碳与氧化铁反应的化学方程式可以计算出需要赤铁矿石的质量.
解答:解:
(1)根据题意“密度最小的气体”为氢气,则气体B为氢气,氢气具有可燃性,它的一种用途是作燃料(或由于氢气密度小,可以做氢气球).
(2)反应①导致每年有大量的铁锈蚀,为阻止铁锈蚀的发生,人们常采用在铁表面涂刷油漆或镀上其他金属等方法.铁锈蚀的原理是铁与 O2 和 H2O接触.
(3)根据废液中成分CuSO4、ZnSO4、FeSO4,可知加入过量的锌粉是把能与锌反应的物质都反应掉,锌可以与硫酸铜反应,锌可以与硫酸亚铁反应,所以步骤①中锌粉必须过量的原因是将废液中的Cu2+和Fe2+全部置换出来;根据锌与硫酸铜反应的反应物是锌和硫酸铜,生成物是铜和硫酸锌,写出方程式即可:Zn+CuSO4=ZnSO4+Cu;步骤④中加入的稀硫酸是为了和锌反应,主要看是否有没反应的锌就行,所以步骤④中加入的稀硫酸是否足量的方法是:取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生则酸不足量,否则酸足量;硫酸新的来源有三部分:原来的硫酸锌、锌与硫酸铜、硫酸亚铁反应生成的硫酸锌;过量的锌与硫酸反应生成的硫酸锌;所以说最终所得硫酸锌的质量大于原废液中硫酸锌的质量.
(4)解:解法(一)设需要含氧化铁75%的赤铁矿石的质量是x
x×75%×
×100%=21t×(1-3.00%)
解得:x=38.8t
解法(二)设需要含氧化铁75%的赤铁矿石的质量是x
Fe2O3+3CO
2Fe+3CO2
160 112
x×75% 21t×(1-3.00%)
=
解得:x=37.0t
答:需要含氧化铁质量分数为75%的赤铁矿石的质量是38.8t.
(1)做燃料;(2)O2; H2O;(3)a.确保废液中的CuSO4、FeSO4完全反应; b.Zn+CuSO4=ZnSO4+Cu;
c.向固体D中加入稀硫酸,若有气泡产生,说明加入的稀硫酸不足量; d.>; (4)38.8 t
(1)根据题意“密度最小的气体”为氢气,则气体B为氢气,氢气具有可燃性,它的一种用途是作燃料(或由于氢气密度小,可以做氢气球).
(2)反应①导致每年有大量的铁锈蚀,为阻止铁锈蚀的发生,人们常采用在铁表面涂刷油漆或镀上其他金属等方法.铁锈蚀的原理是铁与 O2 和 H2O接触.
(3)根据废液中成分CuSO4、ZnSO4、FeSO4,可知加入过量的锌粉是把能与锌反应的物质都反应掉,锌可以与硫酸铜反应,锌可以与硫酸亚铁反应,所以步骤①中锌粉必须过量的原因是将废液中的Cu2+和Fe2+全部置换出来;根据锌与硫酸铜反应的反应物是锌和硫酸铜,生成物是铜和硫酸锌,写出方程式即可:Zn+CuSO4=ZnSO4+Cu;步骤④中加入的稀硫酸是为了和锌反应,主要看是否有没反应的锌就行,所以步骤④中加入的稀硫酸是否足量的方法是:取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生则酸不足量,否则酸足量;硫酸新的来源有三部分:原来的硫酸锌、锌与硫酸铜、硫酸亚铁反应生成的硫酸锌;过量的锌与硫酸反应生成的硫酸锌;所以说最终所得硫酸锌的质量大于原废液中硫酸锌的质量.
(4)解:解法(一)设需要含氧化铁75%的赤铁矿石的质量是x
x×75%×
| 112 |
| 160 |
解得:x=38.8t
解法(二)设需要含氧化铁75%的赤铁矿石的质量是x
Fe2O3+3CO
| ||
160 112
x×75% 21t×(1-3.00%)
| 160 |
| x?75% |
| 112 |
| 21t×(1-3.00%) |
解得:x=37.0t
答:需要含氧化铁质量分数为75%的赤铁矿石的质量是38.8t.
(1)做燃料;(2)O2; H2O;(3)a.确保废液中的CuSO4、FeSO4完全反应; b.Zn+CuSO4=ZnSO4+Cu;
c.向固体D中加入稀硫酸,若有气泡产生,说明加入的稀硫酸不足量; d.>; (4)38.8 t
点评:此题是一道推断题,解题的关键是抓住题目中关于氢气以及物质间的转化关系,属一道基础性推断题.解答本题的关键是B是密度最小的气体,C为紫红色固体单质,所以说B是氢气,C是铜,再进一步进行推断即可.赤铁矿石中铁元素的质量为矿石中氧化铁所含铁元素的质量,可以根据铁元素的质量守恒来做,也可以根据化学方程式进行求算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
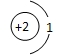 D、原子结构示意图为
D、原子结构示意图为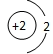
 D、原子结构示意图为
D、原子结构示意图为