题目内容
【题目】如图是用来测定空气中氧气含量的装置。下列有关说法正确的是( )
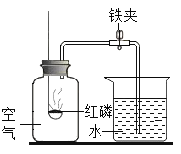
A.红磷燃烧时产生大量白色烟雾
B.燃烧匙中的红磷不可换成细铁丝
C.燃烧匙中的红磷越多,水位上升越高
D.本实验还可以证明空气中含有![]() 、
、![]() 、CO和稀有气体
、CO和稀有气体
【答案】B
【解析】
用红磷燃烧测定空气中氧气的含量,主要是注意红磷燃烧的现象,测定氧气的实验原理。
A、红磷燃烧生成![]() ,而
,而![]() 是白色固体,不会形成雾,故不符合题意;
是白色固体,不会形成雾,故不符合题意;
B、红磷在空气中可以燃烧,消耗氧气,而细铁丝不能在空气中燃烧,不消耗氧气,要测定氧气的含量,必须能消耗氧气,故不可换成细铁丝,符合题意;
C、红磷燃烧,消耗空气中的氧气,容器内压强减小,打开弹簧夹后,水位会上升,而上升的量即为消耗的氧气的量,红磷量多,但空气中氧气的量是一定的,消耗完后,红磷就不能继续燃烧了,故水位上升的高度不随红磷的增多而变高,不符合题意;
D、本实验能证明空气中有支持燃烧的氧气,和不支持燃烧的氮气,而不能证明空气中有CO和稀有气体等其他气体,故不符合题意。
故选B。

 53随堂测系列答案
53随堂测系列答案【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()
【题目】钠及其化合物是中学化学学习和研究的重要内容,以下是对这一知识模块的梳理和认知,请你共同参与。
知识点一、认识钠元素及氯化钠的形成:
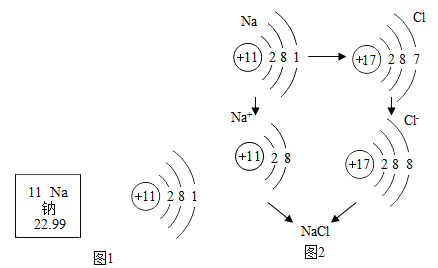
(1)下列是某同学据图1获得的信息,其中正确的是________________(填序号);
①钠元素属于金属元素
②钠的相对原子质量为22.99g
③钠原子在化学反应中易得到电子
④![]() 表示原子核带11个单位正电荷
表示原子核带11个单位正电荷
(2)图2是氯化钠的形成过程,其微观实质是________________________。
(3)由图推测下列说法正确的是(填序号)________________________。
①原子形成离子的过程中,结构中的电子数一定改变
②原子形成离子的过程中,电子层数一定改变
③原子形成离子的过程中,质子数一定不变
④化学变化中元素种类一定不变
知识点二、探究氢氧化钠的化学性质
为验证氢氧化钠的化学性质,设计了如下图所示实验方案:
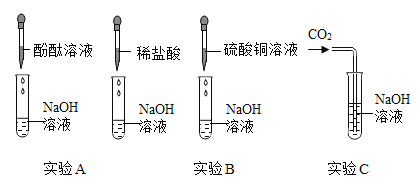
(1)实验A验证了氢氧化钠的两条化学性质,其中酚酞试液所起的作用是________________
(2)实验B中发生反应的化学方程式为_________________________。
(3)实验C没有观察到明显现象,于是他们展开了如下探究:制取纯净、干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应。
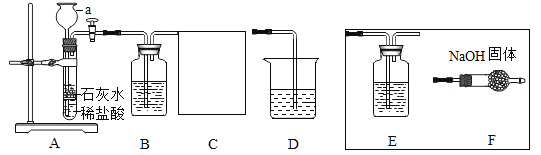
(查阅资料)
①碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
②20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示。
物质 | NaOH |
|
|
溶解度/g | 110 | 21.8 | 9.6 |
(定性探究)
①装置A中发生反应的化学方程式为:____________________________________;
②装置B中盛有![]() 溶液,目的是____________________________________;
溶液,目的是____________________________________;
③图中C处装置应该选择_________(选填E或F)达到实验目的;
④在实验过程中装置D中观察到___________________________,说明![]() 和NaOH溶液能发生反应。
和NaOH溶液能发生反应。
(定量计算)
20℃时,装置D中盛有210g NaOH的饱和溶液,经测定,实验过程中装置D的温度保持20℃。试计算:
⑤装置D中210g NaOH饱和溶液含有NaOH的质量是__________________g;
⑥装置D中NaOH全部转化成![]() 时理论上最多可以生成
时理论上最多可以生成![]() 的质量是_________g;
的质量是_________g;
⑦当向装置D中通入足量的![]() 时,可以将NaOH全部转化为
时,可以将NaOH全部转化为![]() ,实验过程中会析出
,实验过程中会析出![]() 的质量为__________________g(不考虑结晶水)。
的质量为__________________g(不考虑结晶水)。
知识点三、对比碳酸钠和碳酸氢钠的化学性质
(1)比较碳酸钠和碳酸氢钠两种溶液的酸碱性
(查阅资料)
20℃ | 8% | 8% |
pH | 10.6 | 8.0 |
现有20℃时溶质质量分数为8%的![]() 和
和![]() 溶液,由数据可知两种溶液都显____________(填“酸性”、“碱性”或“中性”);这两种物质中常用作治疗胃酸过多的药剂是____________
溶液,由数据可知两种溶液都显____________(填“酸性”、“碱性”或“中性”);这两种物质中常用作治疗胃酸过多的药剂是____________
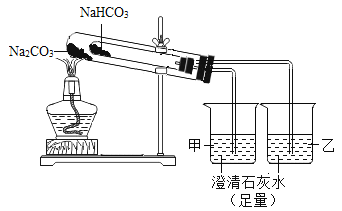
(2)比较碳酸钠和碳酸氢钠的热稳定性:
按图实验,充分加热后,观察到的现象:大试管内固体物质无明显变化,小试管内壁有水珠生成;甲烧杯中石灰水无明显现象,乙烧杯中石灰水变浑浊。试回答
①在实验结束时,操作上要注意的问题是____________________
②由实验可以得出的结论是________________________________