题目内容
下面是某学习小组对Cu、Fe、Mg、Ag、Al五种金属相关知识的学习.请你参与并回答问题:
(1)下列制品中,主要利用金属导电性的是

(2)铝的原子结构示意图为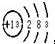 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)
(3)铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)
CuSO4+X↑+2H2O,则X的化学式为
(4)Cu、Fe、Mg、Ag、Al五种金属中,金属活动性最强的是
(1)下列制品中,主要利用金属导电性的是
B
B
(填序号,下同).
(2)铝的原子结构示意图为
 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)失
失
电子.(3)铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)
| ||
SO2
SO2
.(4)Cu、Fe、Mg、Ag、Al五种金属中,金属活动性最强的是
Mg
Mg
,写出其与盐酸反应的化学方程式Mg+2HCl═MgCl2+H2↑
Mg+2HCl═MgCl2+H2↑
.分析:(1)依据金属的用途和性质加以分析;
(2)依据原子结构示意图中的最外层电子数进行判断;
(3)依据质量守恒定律进行推断;
(4)依据金属活动性顺序表进行判断.
(2)依据原子结构示意图中的最外层电子数进行判断;
(3)依据质量守恒定律进行推断;
(4)依据金属活动性顺序表进行判断.
解答:解:(1)A.铁锅是主要利用铁的导热性;
B.铜导线主要利用铜的导电性;
C.铝箔主要利用铝的延展性.
故答案为:B.
(2)从原子结构示意图上看,最外层电子数少于4个易失电子,最外层电子数等于或多于4个易得电子.故答案为:失.
(3)据质量守恒定律,在反应前后各元素原子的个数不变.从Cu+2H2SO4(浓)
CuSO4+X↑+2H2O从看Cu、H反应前后除物质x外个数已经相等,故x中无 Cu、H.S反应前共有2个,反应后除x外有1个,所以x中有1个;O反应前有8个,反应后x除外有6个,所以x中有2个.故答案为:SO2
(4)在金属活动性顺序表中,越排在前面的金属活动性最强.Cu、Fe、Mg、Ag、Al五种金属中Mg在金属活动性顺序表中最靠前.镁与稀盐酸反应,反应物是镁与氯化氢,产物是氯化镁与氢气.
故答案为:Mg Mg+2HCl═MgCl2+H2↑
B.铜导线主要利用铜的导电性;
C.铝箔主要利用铝的延展性.
故答案为:B.
(2)从原子结构示意图上看,最外层电子数少于4个易失电子,最外层电子数等于或多于4个易得电子.故答案为:失.
(3)据质量守恒定律,在反应前后各元素原子的个数不变.从Cu+2H2SO4(浓)
| ||
(4)在金属活动性顺序表中,越排在前面的金属活动性最强.Cu、Fe、Mg、Ag、Al五种金属中Mg在金属活动性顺序表中最靠前.镁与稀盐酸反应,反应物是镁与氯化氢,产物是氯化镁与氢气.
故答案为:Mg Mg+2HCl═MgCl2+H2↑
点评:此题考查各种金属的物理性质和在化学反应中原子得失电子的规律以及金属活动性顺序表.此题很简单,已在考察基础知识的运用.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目

 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)
 ,据此不能确定的是
,据此不能确定的是
 ,该原子在化学反应中易(填“得”或“失”)______电子.
,该原子在化学反应中易(填“得”或“失”)______电子. CuSO4+X↑+2H2O,则X的化学式为______.
CuSO4+X↑+2H2O,则X的化学式为______.
 ,据此不能确定的是______.
,据此不能确定的是______.
 ,该原子在化学反应中易(填“得”或“失”) 电子.
,该原子在化学反应中易(填“得”或“失”) 电子. CuSO4+X↑+2H2O,则X的化学式为 .
CuSO4+X↑+2H2O,则X的化学式为 .