题目内容
(2012?宝坻区二模)下面是某学习小组对Cu、Fe、Mg、Ag、Al五种金属相关知识的学习与探究.请你参与并回答问题:
(1)下列金属制品中,颜色为紫红色的是

(2)以上金属中,某原子结构示意图为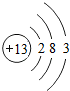 ,据此不能确定的是
,据此不能确定的是
A.元素种类 B.原子的质子数
C.相对原子质量 D.该原子失电子后成为阳离子
(3)铜与浓硫酸在一定条件下可以反应,其化学方程式为:
Cu+2H2SO4(浓)
CuSO4+X↑+2H2O,则X的化学式为
(4)Cu、Fe、Mg、Ag、Al五种金属分别放入到同一盐酸中,最剧烈反应的化学方程式为
(5)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,能得出的结论是
A.滤渣中一定有Fe B.滤渣中一定有Cu
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu2+.
(1)下列金属制品中,颜色为紫红色的是
C
C
(填序号,下同).
(2)以上金属中,某原子结构示意图为
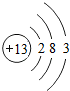 ,据此不能确定的是
,据此不能确定的是C
C
.A.元素种类 B.原子的质子数
C.相对原子质量 D.该原子失电子后成为阳离子
(3)铜与浓硫酸在一定条件下可以反应,其化学方程式为:
Cu+2H2SO4(浓)
| ||
SO2
SO2
.(4)Cu、Fe、Mg、Ag、Al五种金属分别放入到同一盐酸中,最剧烈反应的化学方程式为
Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑
.(5)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,能得出的结论是
C
C
.A.滤渣中一定有Fe B.滤渣中一定有Cu
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu2+.
分析:(1)铜是紫红色固体;
(2)根据原子结构示意图不能确定相对原子质量;
(3)根据质量守恒定律可以判断物质的化学式;
(4)Cu、Fe、Mg、Ag、Al等五种金属中,镁最活泼;
(5)在金属活动性顺序中,排在氢前面的金属,能够和稀盐酸、稀硫酸发生置换反应,生成氢气和相应的盐;排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来.
(2)根据原子结构示意图不能确定相对原子质量;
(3)根据质量守恒定律可以判断物质的化学式;
(4)Cu、Fe、Mg、Ag、Al等五种金属中,镁最活泼;
(5)在金属活动性顺序中,排在氢前面的金属,能够和稀盐酸、稀硫酸发生置换反应,生成氢气和相应的盐;排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来.
解答:解:(1)颜色为紫红色的是铜.
故填:C.
(2)由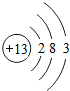 可知,该元素是铝元素,原子的质子数是13,该原子失电子后成为阳离子,不能确定相对原子质量.
可知,该元素是铝元素,原子的质子数是13,该原子失电子后成为阳离子,不能确定相对原子质量.
故填:C.
(3)由Cu+2H2SO4(浓)
CuSO4+X↑+2H2O可知,每个X中含有1个硫原子和2个氧原子,是二氧化硫,则二氧化硫的化学式为SO2.
故填:SO2.
(4)Cu、Fe、Mg、Ag、Al等五种金属中,镁最活泼,与稀盐酸反应最剧烈,反应的化学方程式为:Mg+2HCl=MgCl2+H2↑.
故填:Mg+2HCl=MgCl2+H2↑.
(5)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉时,铁先和硝酸银反应生成硝酸亚铁和银,当硝酸银完全反应后,铁再和硝酸铜反应生成硝酸亚铁和铜;
充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生,说明滤渣中不含有铁.
A.滤渣中一定没有Fe.不正确;
B.滤渣中不一定有Cu,当铁不足以和硝酸银反应,或恰好和硝酸银反应时,滤渣中不含有铜.不正确.
C.滤液中一定有Fe2+,因为铁和硝酸银反应生成硝酸亚铁和银,硝酸亚铁在水中能够电离出Fe2+.正确.
D.滤液中不一定有Ag+、Cu2+,当铁的量恰好和硝酸银、硝酸铜完全反应时,滤液中不含有Ag+、Cu2+.不正确.
故填:C.
故填:C.
(2)由
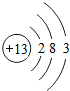 可知,该元素是铝元素,原子的质子数是13,该原子失电子后成为阳离子,不能确定相对原子质量.
可知,该元素是铝元素,原子的质子数是13,该原子失电子后成为阳离子,不能确定相对原子质量.故填:C.
(3)由Cu+2H2SO4(浓)
| ||
故填:SO2.
(4)Cu、Fe、Mg、Ag、Al等五种金属中,镁最活泼,与稀盐酸反应最剧烈,反应的化学方程式为:Mg+2HCl=MgCl2+H2↑.
故填:Mg+2HCl=MgCl2+H2↑.
(5)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉时,铁先和硝酸银反应生成硝酸亚铁和银,当硝酸银完全反应后,铁再和硝酸铜反应生成硝酸亚铁和铜;
充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生,说明滤渣中不含有铁.
A.滤渣中一定没有Fe.不正确;
B.滤渣中不一定有Cu,当铁不足以和硝酸银反应,或恰好和硝酸银反应时,滤渣中不含有铜.不正确.
C.滤液中一定有Fe2+,因为铁和硝酸银反应生成硝酸亚铁和银,硝酸亚铁在水中能够电离出Fe2+.正确.
D.滤液中不一定有Ag+、Cu2+,当铁的量恰好和硝酸银、硝酸铜完全反应时,滤液中不含有Ag+、Cu2+.不正确.
故填:C.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
相关题目
 (2012?宝坻区二模)如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )
(2012?宝坻区二模)如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )