题目内容
下面是某学习小组对Cu、Fe、Mg、Ag、Al五种金属相关知识的学习与探究.请你参与并回答问题:
(1)下列制品中,主要利用金属导电性的是______(填序号,下同).

(2)铝的原子结构示意图为 ,该原子在化学反应中易(填“得”或“失”)______电子.
,该原子在化学反应中易(填“得”或“失”)______电子.
(3)铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓) CuSO4+X↑+2H2O,则X的化学式为______.
CuSO4+X↑+2H2O,则X的化学式为______.
(4)所给五种金属分别放入到同一盐酸中,最剧烈的反应的化学方程式为______.
(5)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,能得出的结论是______.
A.滤渣中一定有Fe B.滤渣中一定有Cu C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu2+.
解:(1)铜导线常用在电器上,主要是利用了其具有导电性的物理性质.
故选B.
(2)核外电子的最外层电子数决定了其物理性质,最外层电子数小于3的原子,化学反应中易失去电子.
故答案为:失.
(3)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,可推断化学方程式为:Cu+2H2SO4(浓) CuSO4+2H2O+X↑ 中X的化学式为SO2.
CuSO4+2H2O+X↑ 中X的化学式为SO2.
故答案为:SO2.
(4)所给五种金属分别放入到同一盐酸中,最剧烈的反应即是化学活动性最强的金属,在五种金属中镁的活动性最强,反应最剧烈.
故答案为:Mg+2HCl═MgCl2 +H2↑.
(5)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选C.
分析:(1)铜导线常用在电器连接上,主要是利用了其导电性.
(2)最外层电子数小于3的原子,化学反应中易失去电子.
(3)依据质量守恒定律中原子的种类及数量不变解决.
(4)利用金属活动性顺序解决.
(5)根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;
过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.
点评:此题是对金属性质的考查题,解题的关键是对相关金属的活动性以及物理性质的掌握与理解,题目综合性较强,能训练学生的综合性思维.
故选B.
(2)核外电子的最外层电子数决定了其物理性质,最外层电子数小于3的原子,化学反应中易失去电子.
故答案为:失.
(3)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,可推断化学方程式为:Cu+2H2SO4(浓)
 CuSO4+2H2O+X↑ 中X的化学式为SO2.
CuSO4+2H2O+X↑ 中X的化学式为SO2.故答案为:SO2.
(4)所给五种金属分别放入到同一盐酸中,最剧烈的反应即是化学活动性最强的金属,在五种金属中镁的活动性最强,反应最剧烈.
故答案为:Mg+2HCl═MgCl2 +H2↑.
(5)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选C.
分析:(1)铜导线常用在电器连接上,主要是利用了其导电性.
(2)最外层电子数小于3的原子,化学反应中易失去电子.
(3)依据质量守恒定律中原子的种类及数量不变解决.
(4)利用金属活动性顺序解决.
(5)根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;
过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.
点评:此题是对金属性质的考查题,解题的关键是对相关金属的活动性以及物理性质的掌握与理解,题目综合性较强,能训练学生的综合性思维.

练习册系列答案
相关题目

 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)
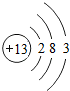 ,据此不能确定的是
,据此不能确定的是
 ,据此不能确定的是______.
,据此不能确定的是______.
 ,该原子在化学反应中易(填“得”或“失”) 电子.
,该原子在化学反应中易(填“得”或“失”) 电子. CuSO4+X↑+2H2O,则X的化学式为 .
CuSO4+X↑+2H2O,则X的化学式为 .