题目内容
同学们为了研究氧化铁能否在氯酸钾制取氧气的实验中起催化作用,进行了以下实验:
【资料】①氯酸钾分解反应的化学方程式为 2KClO3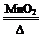 2KCl+3O2↑。
2KCl+3O2↑。
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
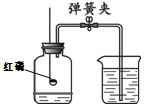
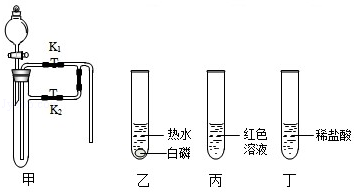
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
【资料】①氯酸钾分解反应的化学方程式为 2KClO3
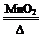 2KCl+3O2↑。
2KCl+3O2↑。②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| | 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |
(1)0.2 (2)对比 (3)氧化铁能在氯酸钾制取氧气实验中加快反应速率
(答“氧化铁能做氯酸钾制取氧气的催化剂”不得分(4)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(5)氧化铁固体是红色,而所得固体都是黑色 ①黑色固体全部被吸引
②向剩余固体中加入足量硫酸铜溶液 ③黑色固体全部变成红色(其他方案合理即可)
(答“氧化铁能做氯酸钾制取氧气的催化剂”不得分(4)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2(5)氧化铁固体是红色,而所得固体都是黑色 ①黑色固体全部被吸引
②向剩余固体中加入足量硫酸铜溶液 ③黑色固体全部变成红色(其他方案合理即可)
试题分析:(1)在对比实验中变量只有催化剂,故氧化铁的质量为0.2g,(2)以上实验采用了对比的实验方法;(3)因为实验目的是探究氧化铁能否在氯酸钾制取氧气实验中加快反应速率,由实验可知氧化铁能在氯酸钾制取氧气实验中加快反应速率;(4)实验现象是红色固体全部变黑,实验结论是生成了铁,故发生的化学方程式为:3CO + Fe2O3
 2Fe + 3CO2 (5)因为氧化铁固体是红色,而所得固体都是黑色,所以剩余固体中一定没有氧化铁;①因为实验结论是剩余固体中没有氧化亚铁且氧化亚铁磁铁不能吸引,故实验现象为黑色固体全部被吸引;②向剩余固体中加入足量硫酸铜溶液 ③黑色固体全部变成红色(其他方案合理即可)。
2Fe + 3CO2 (5)因为氧化铁固体是红色,而所得固体都是黑色,所以剩余固体中一定没有氧化铁;①因为实验结论是剩余固体中没有氧化亚铁且氧化亚铁磁铁不能吸引,故实验现象为黑色固体全部被吸引;②向剩余固体中加入足量硫酸铜溶液 ③黑色固体全部变成红色(其他方案合理即可)。
练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目