题目内容
【题目】现有HCl和MgCl2的混合溶液共60g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的10%的NaOH溶液质量关系如图所示。求:
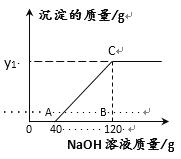
(1)与混合溶液中的盐酸恰好完全中和时消耗的氢氧化钠溶液的质量为________克。
(2)上述反应中生成的氢氧化镁沉淀的质量______。
(3)计算反应至C点时溶液中溶质的质量分数______?
【答案】40 5.8g 10.07%
【解析】
向HCl和MgCl2的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,先发生酸碱中和反应:HCl+NaOH=NaCl+H2O,再发生沉淀反应:2NaOH + MgCl2 =Mg(OH)2![]() + 2NaCl 。
+ 2NaCl 。
(1)由图示可知,开始加入的氢氧化钠先与盐酸反应没有沉淀生成,直到加入的氢氧化钠与混合溶液中的盐酸恰好完全中和时,消耗的氢氧化钠溶液的质量为40g。
故答案为:40。
(2)由图示可知,与氯化镁反应的氢氧化钠溶液的质量为120g-40g=80g,与氯化镁反应的氢氧化钠质量为80g×10%=8g,设反应中生成氢氧化镁沉淀的质量为X,生成氯化钠的质量为Y。
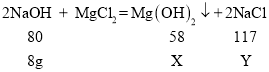 ,
,
![]() , X=5.8g,
, X=5.8g,![]() ,Y=11.7g ,
,Y=11.7g ,
即生成氢氧化镁沉淀的质量为5.8g,生成氯化钠的质量为11.7g。
故答案为:5.8g。
(3)反应至C点时溶液中溶质只有NaCl,包括两部分,一部分是氢氧化钠与盐酸反应生成的,另一部分是氢氧化钠与氯化镁反应生成的11.7g。
设与盐酸反应生成的氯化钠质量为Z,
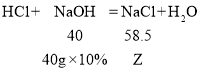
![]() , Z=5.85g , 即氢氧化钠与盐酸反应生成的氯化钠质量为5.85g。两部分共产生氯化钠质量为:11.7g+5.85g=17.55g,则反应至C点时溶液中溶质的的质量分数=
, Z=5.85g , 即氢氧化钠与盐酸反应生成的氯化钠质量为5.85g。两部分共产生氯化钠质量为:11.7g+5.85g=17.55g,则反应至C点时溶液中溶质的的质量分数=![]() 。
。

练习册系列答案
相关题目