题目内容
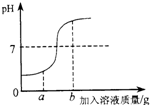
 22、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.
22、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.(1)该反应的化学方程式为:
NaOH+HCl=NaCl+H2O
.(2)该实验操作是将
氢氧化钠溶液
滴加到另一种溶液中.(3)当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式)
HCl、NaCl
.(4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈
红
色.分析:(1)氢氧化钠和盐酸反应能生成氯化钠和水;
(2)盐酸显酸性,pH小于7,氢氧化钠溶液显碱性,pH大于7;
(3)当盐酸过量时,盐酸和氢氧化钠反应后的溶液中含有氯化氢、氯化钠;
(4)显碱性的溶液能使酚酞试液变红色.
(2)盐酸显酸性,pH小于7,氢氧化钠溶液显碱性,pH大于7;
(3)当盐酸过量时,盐酸和氢氧化钠反应后的溶液中含有氯化氢、氯化钠;
(4)显碱性的溶液能使酚酞试液变红色.
解答:解:(1)稀盐酸和氢氧化钠溶液反应的化学方程式为:NaOH+HCl=NaCl+H2O.
(2)开始时溶液的pH小于7,说明是把氢氧化钠溶液滴加到稀盐酸中.故填:氢氧化钠溶液.
(3)当加入溶液的质量为ag时,溶液的pH小于7,说明盐酸过量,所得溶液中的溶质为氯化氢和氯化钠.故填:HCl、NaCl.
(4)当加入溶液的质量为bg时,溶液的pH大于7,溶液显碱性,显碱性的溶液能使酚酞试液变红色.故填:红.
(2)开始时溶液的pH小于7,说明是把氢氧化钠溶液滴加到稀盐酸中.故填:氢氧化钠溶液.
(3)当加入溶液的质量为ag时,溶液的pH小于7,说明盐酸过量,所得溶液中的溶质为氯化氢和氯化钠.故填:HCl、NaCl.
(4)当加入溶液的质量为bg时,溶液的pH大于7,溶液显碱性,显碱性的溶液能使酚酞试液变红色.故填:红.
点评:本题主要考查溶液的酸碱性和pH之间的关系,同时考查了化学方程式的书写方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
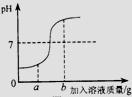 18、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中该溶液的酸碱度变化如图:(1)该反应的化学方程式为:
18、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中该溶液的酸碱度变化如图:(1)该反应的化学方程式为: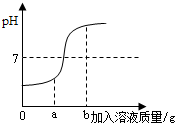 (2013?白城一模)在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.
(2013?白城一模)在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.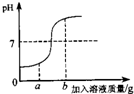 (在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.
(在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示.