题目内容
【题目】金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是_____。(填“符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。
![]()
(ⅰ)变化②中,铁钉主要与空气中的_____发生反应。
(ⅱ)变化③中除去铁锈的化学方程式为_____。
(ⅲ)如果用a、b分别代表光亮的铁钉和无锈铁钉,则它们的质量关系_____
A a<b B a>b C a=b D 无法比较
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验,你认为不需要进行的实验是_____(填字母序号)。
A 将铁粉放入硫酸锌溶液中 B 将铁粉放入稀硫酸中
C 将铁粉放入硫酸铜溶液中 D 将铜片放入稀硫酸中
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素。图中部分物质略去)。Mr(碱式碳酸铜)=222
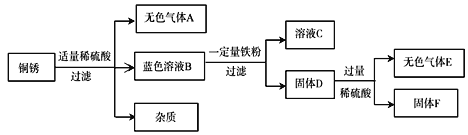
①无色气体A是_____,溶液C中所含的阳离子是_____,固体D中含有的物质是_____。
②在蓝色溶液B中加入铁粉时,发生反应的化学方程式为_____。
③已知铜锈样品的质量是10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是_____。
【答案】Al H2O、O2 Fe2O3+6HCl=2FeCl3+3H2O B C CO2 Fe2+ 铁、铜 Fe+CuSO4=Cu+FeSO4 55.5%
【解析】
(1)地壳中含量最多的金属元素是铝,故填Al;
(2)(ⅰ)铁钉生锈是铁与空气中的水和氧气反应,故变化②中,铁钉主要与空气中的水和氧气发生反应;
(ⅱ)铁锈的主要成分是Fe2O3,变化③中除去铁锈的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(ⅲ)氧化铁和盐酸反应导致部分铁元素以铁离子的形式溶解到溶液中了,使剩下的铁质量减轻,因此a>b.故选B;
(3)将铁粉放入硫酸锌溶液中,无明显现象,说明锌比铁活泼,将铁粉放入稀硫酸中,有气泡产生,说明铁排在氢的前面,将铜片放入稀硫酸中,无明显现象,说明铜排在氢的后面,由此可知,锌、铁、铜三种金属的活动性为锌>铁>(氢)>铜;可以省略的实验是将铁粉放入硫酸铜溶液中.
故填:C.
(4)①碱式碳酸铜和稀硫酸反应能生成硫酸铜、水和二氧化碳,无色气体是二氧化碳;向固体D中加入过量稀硫酸时,产生无色气体,是氢气,是由稀硫酸和铁反应生成的,说明铁粉过量,溶液C中所含的溶质是硫酸亚铁,阳离子是亚铁离子;
固体D中含有生成的铜和过量的铁粉.故填:二氧化碳; Fe2+;铁、铜;
②蓝色溶液B是硫酸铜溶液,能和铁反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;
③设Cu2(OH)2CO3的质量分数为x,固体F是铜,即生成的铜的质量是3.2g,
![]() =3.2g,解得x=55.5%.故填:55.5%。
=3.2g,解得x=55.5%.故填:55.5%。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:

(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。