题目内容
【题目】A、B、C、D、E、F、G是常见物质,B是一种气体单质,E是红色的固体单质, D是浅绿色溶液,G是蓝色溶液,它们可以发生如下转化关系:
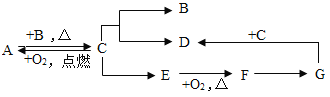
(1)推出下列物质的化学式:A _______、B _________、E________
(2)写出下列转化的化学方程式:
E——F:_______________
G——D:______________
(3)F转化为G的反应____________置换反应(填“都是”、“不一定是”或“不是”)。
【答案】Fe3O4 H2 Cu 2Cu+O2![]() 2CuO Fe+CuSO4=FeSO4+Cu(写铁和氯化铜反应也对) 不是
2CuO Fe+CuSO4=FeSO4+Cu(写铁和氯化铜反应也对) 不是
【解析】
(1)A、B、C、D、E、F、G是常见物质,B是一种气体单质,D是浅绿色溶液,C会转化成B、D,所以C是铁,B是氢气,D中含有亚铁离子,可以是硫酸亚铁,铁和氧气点燃生成四氧化三铁,所以A是四氧化三铁,E是红色的固体单质,所以E是铜,铜和氧气加热生成氧化铜,所以F是氧化铜,G是蓝色溶液,所以G可以是硫酸铜,铁和硫酸铜反应生成硫酸亚铁和铜,经过验证,推导正确,所以A是Fe3O4,B是H2,E是Cu;
(2)E--F的反应是铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O2![]() 2CuO;
2CuO;
G--D的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(3)F转化为G的反应是氧化铜和硫酸反应生成硫酸铜和水,不是置换反应。

 春雨教育同步作文系列答案
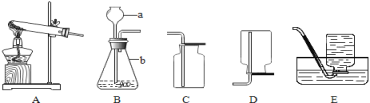
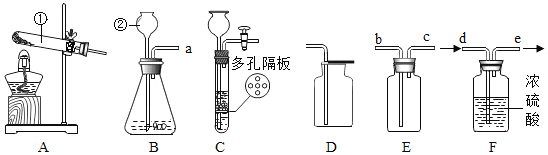
春雨教育同步作文系列答案【题目】实验一:如图是实验室制取气体常用的装置,回答问题:
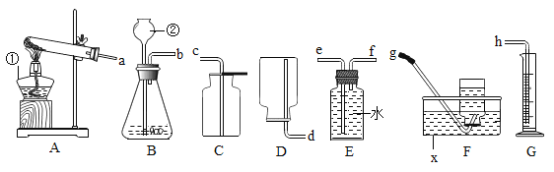
(1)写出标号仪器的名称:①___________________、②_______________________;
(2)若实验室要用同一装置制取并收集O2和CO2,最好选择____________装置组合(填标号),写出用该装置制取O2的化学方程式____________________________________________________________。
(3)实验室用锌与稀硫酸反应来制取氢气并测定氢气的体积,请从图中选择最佳的装置进行组合,整套装置的导管口连接顺序是________(填标号)
Aa→d Bb→g Cb→e→f→h Db→f→e→h
(4)氨气(NH3)是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气。可选用如图中____________(填标号)装置组合制取并收集氨气。若用如图装置收集,氨气应从________(填“a”或“b”)导管口进入。
实验二:某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体。为确定产生的气体和白色固体的成分,该同学进行了如下的探究。
(查阅资料)①Mg(HCO3)2能溶于水;
②MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
③碱石灰主要成分是NaOH和CaO的混合物。
(猜想假设)①白色固体可能是Mg(OH)2;
②白色固体可能是MgCO3;
③白色固体可能是__________________。
(进行实验)
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无明显现象,则该气体为_________。
(2)对白色固体进行实验:
实验步骤 | 现象 | 结论 |
①取洗净后的白色固体,加入足量的________ | 观察到______ | 白色固体一定含有MgCO3 |
②取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体一定含有_______,可能含有___。 |
(反思评价)为进一步确定可能含有的物质,对实验②如何改进,写出具体的操作方法和结论_______________。
【题目】如图是模拟海水制盐的流程
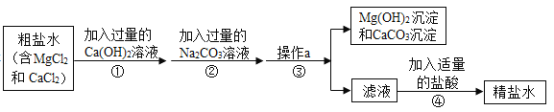
(1)为了证明第①步所加的Ca(OH)2溶液已过量,某同学取少量①反应后的上层清液,向其中继续加入Ca(OH)2溶液,若_____________(填实验现象),则证明Ca(OH)2溶液已过量。
(2)实验结束后,兴趣小组对滤液进行探究
(提出问题)滤液中除了含有水和氯化钠外,还含有哪些溶质?
(提出猜想)根据实验①②③的操作后,作出如下猜想
猜想一:由于在②中加入了过量的碳酸钠溶液,所以滤液中除了含有水和氯化钠外,还仅含过量的___________.
猜想二:由于在①加入了过量的氢氧化钙,发生反应生成了氢氧化镁和氯化钙,所以滤液中除了含有水和氯化钠外,只含有反应生成的氯化钙.
猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有___________和___________.
(验证猜想)
步骤 | 实验操作 | 实验现象 | 推断 |
1 | 取少量滤液于试管中,加入过量的氯化钙溶液,振荡,静置 | ___________ | 滤液中还含有___________溶质 |
2 | 取步骤1反应后的混合液过滤后,取滤液少量于试管中加入__________ | ___________ | 滤液中还含有氢氧化钠 |
(实验结论)经过兴趣小组的实验分析,推出猜想三是正确的.
(反思与拓展)为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式:___________________________________________.
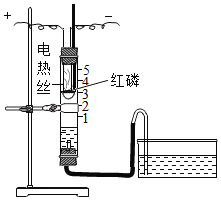
【题目】利用如图装置进行空气中氧气含量测定实验。
实验装置 | 实验操作 |
| I.向玻璃管和水槽内加适量的水,在燃烧匙里放足量红磷,塞紧塞子,上下移动水槽至两边水面相平于玻璃管的零刻度位置。 II.接通电源,待红磷燃烧,断开电源。 III.当温度恢复至室温,水不再进入玻璃管时,上下移动水槽至两边水面相平。 |
(1)实验中加入足量红磷的目的是_____,该实验中发生反应的化学方程式为_____。
(2)实验结束后,玻璃管内水面最终到达刻度线_____(填数字序号)处。
(3)实验操作I、III中,上下移动水槽至两边水面相平的目的是_____。